
分析 根据生成二氧化碳的质量可以求出碳酸钙、氯化氢、氯化钙的质量,从而可以计算所加稀盐酸的溶质质量分数;根据生成的氯化钙的质量、原混合物中氯化钙的质量,求出反应后的溶液中钙元素的质量.
解答 解:根据题意知,生成的二氧化碳的质量为:6g+50g-53.8g=2.2g;所加稀盐酸的质量为:53.8g+2.2g-6g=50g;
(1)设碳酸钙、氯化氢、氯化钙的质量分别为x、y、z,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 73 111 44
x y z 2.2g
$\frac{100}{x}$=$\frac{73}{y}$=$\frac{111}{z}$=$\frac{44}{2.2g}$
x=5g
y=3.65g
z=5.55g
所加稀盐酸的溶质质量分数=$\frac{3.65g}{50g}$×100%=7.3%;
(2)反应后溶液中的氯化钙包括反应生成的和混合物中本来就有的,其质量=5.55g+6g-5g=6.55g,反应后溶液中钙元素的质量=6.55g×$\frac{40}{40+35.5×2}$×100%=2.36g;
答:
(1)所加稀盐酸的溶质质量分数为7.3%;
(2)反应后溶液中钙元素的质量为;2.36g.
点评 本题难度较大,主要考查了以化学方程式计算为基础,同时融入溶液等方面的计算题,这样的题目一直是中考的热点,主要培养学生的综合分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 氯化钾溶液 | 氯化铁 | 加入氢氧化钠溶液至不再产生沉淀 |
| B | 氢氧化钠溶液 | 氢氧化钙 | 通入二氧化碳气体至不再产生沉淀 |
| C | 盐酸 | 硫酸 | 加入氯化钡至不再产生沉淀 |
| D | 氯化钠溶液 | 碳酸钠 | 加入过量的盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
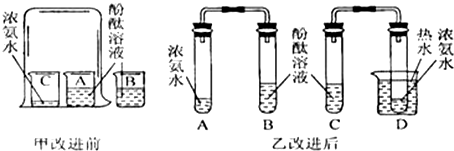
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
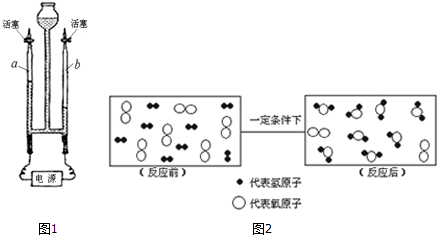
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
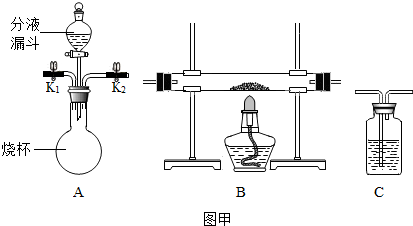
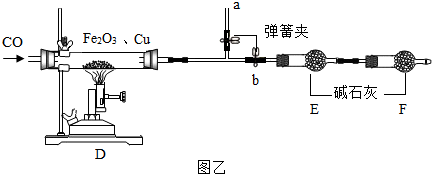
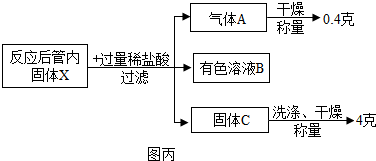
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
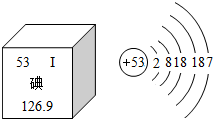 随着日本福岛核电站放射性碘泄露,碘这种元素被人们所认知,如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,下列说法错误的是( )
随着日本福岛核电站放射性碘泄露,碘这种元素被人们所认知,如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图,下列说法错误的是( )| A. | 碘盐中含有碘酸钾(KIO3),KIO3中碘元素的质量分数为52% | |
| B. | 碘原子核外共有53个电子,最外层有7个电子 | |
| C. | 碘元素属于非金属元素,碘原子在化学反应中容易得到电子 | |
| D. | 碘的相对原子质量为126.9,原子核内质子数为53 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com