
�����������Ľṹʾ��ͼ���ش��������⣮
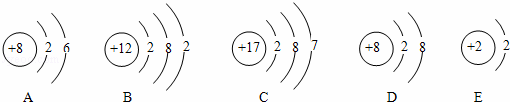
��1��ͼ�й���ʾ������Ԫ�ص��������б�ʾ�����ӵ�������������ţ��������ӷ���Ϊ���������б�ʾϡ������ԭ�ӵ�������������ţ���
��2��B��������Ԫ�أ�����������ǽ�������ϡ�����塱����Bԭ���ڻ�ѧ��Ӧ���γ����ӵķ���Ϊ����
��3��B��CԪ���γɵĻ�����Ļ�ѧʽΪ������
��4��ijԪ��X�γɵĻ�����Ļ�ѧʽΪNa2X����X��ԭ�ӽṹʾ��ͼ����������������ţ���
| ԭ�ӽṹʾ��ͼ�����ӽṹʾ��ͼ����ѧʽ����д�����壮. | |
| ר�⣺ | ��ѧ����������غ㶨�ɣ� |
| ������ | ��1���������Ľṹʾ��ͼ�к��ڵ��������ж����ڼ���Ԫ�ص��������ݺ�������������������֮��Ĺ�ϵ�ж����������ӡ�ϡ������ԭ�ӵ����� ��2������B�����Ľṹʾ��ͼ���ж���������Ԫ�ص����д���γ����ӵķ��ţ� ��3������B��C���Ľṹʾ��ͼ���ص㣬������д��B��CԪ���γɵĻ�����Ļ�ѧʽ�� ��4�����ݻ�ѧʽ�����ж�Ԫ�صĻ��ϼ��Լ������������������� |
| ��� | �⣺��1�������Ľṹʾ��ͼ��֪�����ڵ���������4�֣����ԣ�ͼ�й���ʾ��4 ��Ԫ�ص�������D�����Ľṹʾ��ͼ�У�����������=8�����������=10�����������ӣ���E�����Ľṹʾ��ͼ��֪�������Ǻ�ԭ�ӣ�����ϡ������ԭ�ӣ� ��2����B���Ľṹʾ��ͼ��֪�����ڵ�������12������þԪ�أ��ǽ���Ԫ�أ����������ĵ�������2���ڷ�Ӧ����ʧȥ2�����ӣ��γ�þ���ӣ�����Ϊ��Mg2+�� ��3������BԪ����þԪ�أ�ԭ�ӵ������ĵ�������2���ڷ�Ӧ����ʧȥ2�����ӣ�CԪ������Ԫ�أ�ԭ�ӵ������ĵ�������7���ڷ�Ӧ���õ�1�����ӣ�����B��CԪ���γɵĻ�����Ļ�ѧʽ�ǣ�MgCl2�� ��4����Ԫ��X�γɵĻ�����Ļ�ѧʽΪNa2X����Ϊ�ƵĻ��ϼ�Ϊ+1����֪X�Ļ��ϼ�Ϊ��2�ۣ���X������������Ϊ6��������ͼʾ�е�A�� �ʴ�Ϊ����1��4��D��O2����E����2��12��������Mg2+����3��MgCl2����4��A�� |
| ������ | ��Ҫ������������������Ԫ�ص����࣬�����������Ķ��ٺ�ԭ�ӵ�ʧ���ӵĹ�ϵ������ѧ��Ӧ��֪ʶ�������������� |
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������Ҫʵ����Ҫ�顱���˻�����˼��˵�����˱����̤ʵ�أ���ҵ�����гɣ�ȼ�չ���ȼ����Ҫ�ܿգ�ȼ�ղ��ܸ�������ȼ�յ�������������Ҫ�顱��ʵ���ǣ�������
| �� | A�� | �����ȼ�����ֵ | B�� | ��߿����������ĺ��� |
| �� | C�� | ��߿�ȼ����Ż�� | D�� | �����ȼ��������ĽӴ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ȼ������̼�ĵ��ʣ�Ҳ�кܶຬ��̼Ԫ�صĻ����
�ٵ����е�̼Ԫ�س�Ϊ����̬���������е�̼Ԫ�س�Ϊ ��1�� ��
����Ȼ����̼�Ե�����ʽ���ڵ�������ʯī������ϩ�Լ� ��2�� ����д���ƣ�������̼�г��������������� ��3�� ����д���ƣ���
��д������ϩC60�����á�C����ʾ����������������ȼ�յķ���ʽ ��4�� ��
�ܽ������е�CO2��Ϊ����̬������Ҳ�ɳ�Ϊ����̼����д��һ������̼���ķ���ʽ��
��5�� ��
��̼�ͽ����γɵĻ������̼���ij̼����MC2�к�̼0.375����֪C�����ԭ������Ϊ12 �������M�����ԭ������Ϊ ��6�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������Ʒ���ء��ܻ��������꣮�ڱ����������������ѧʽΪC24H38O4����һ�ֳ����ġ��ܻ�����������˵������ȷ���ǣ�������
| �� | A�� | ���ܻ������������� |
| �� | B�� | ���ܻ�����̼Ԫ�ص������������ |
| �� | C�� | ���ܻ�����̼����Ԫ��������Ϊ6��1 |
| �� | D�� | ���ܻ�����24��̼ԭ�ӡ�38����ԭ�ӡ�4����ԭ�ӹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��FeO��Fe2O3��CaCO3�Ļ�����У���֪��Ԫ�ص���������Ϊ56%����CaCO3���������������ǣ�������
| �� | A�� | 10% | B�� | 25% | C�� | 30% | D�� | 35% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ּס�������ѧС�鰲װ������ͼ1��ͬװ�ã�ͨ���ⶨ������ͬ�����������ʱ�䳤����̽��Ӱ��H2O2�ֽ����ʵ����أ�
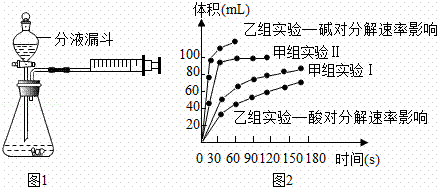
��1�����з����ܼ���װ�������Ե���������
A����ע���������̶������Һ©����ע����������ˮ����Һ©�������������Һ©���������γ��ȶ���ˮ���������������ã���֮�����Բ
B���رշ�Һ©��������������ƿ�����ע�����������ƣ����ƣ���ֹͣ���Ⱥ�ע���������ص�ԭ��λ�ã������������ã���֮�����Բ
C���رշ�Һ©��������������ע�����������ƣ����ƣ���ֹͣ������ע�����������ƶ��������������ã���֮�����Բ
��2��MnO2����H2O2�ֽ�Ļ�ѧ����ʽ����������
��3����С�������ʵ����Ʒ�������������
| ʵ���� | ʵ��Ŀ�� | �¶� | ���� | Ũ�� |
| ����ʵ��� | ̽��������H2O2�ֽ����ʵ�Ӱ�� | 25�� | �������� | 10mL 2%H2O2 |
| ����ʵ��� | 25�� | �������� | 10mL 5%H2O2 |
��4���ס�����С��ó���ͼ2���ݣ�
�ټ���ʵ��ó������ݿ�֪��Ũ��Խ��H2O2�ֽ�����������
���������о����ᡢ���H2O2�ֽ�Ӱ�����ص� ���ݷ�������ͬ�����£�H2O2��������ᡱ����Ի����·ų��������ʽϿ죻�������������Ba02������������Һ��Ӧ��H202����֪��������һ�����ʣ����仯ѧ��Ӧ����ʽΪ������֧����һ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ճ������еı仯�����ڻ����������ǣ� ��
A��ú��ȼ�� B��ˮ����������
C������Ʒ�ڳ�ʪ���������� D���׳����ͨ�緢�ⷢ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com