
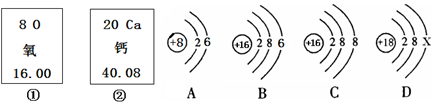
| 温度/℃ | 0 | 15 | 20 | 30 | 40 | 50 | 60 |
| 碳酸氢钠溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 | 12.7 | 14.45 | 16.4 |
| 碳酸钠溶解度/g | 7.7 | 13.25 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
| 实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
| ① | 加入 足量氯化钙溶液 | 有白色沉淀 | 有碳酸钠和氢氧化钠物质 |
| ② | 滴入 酚酞试液 | 酚酞试液变红色 |
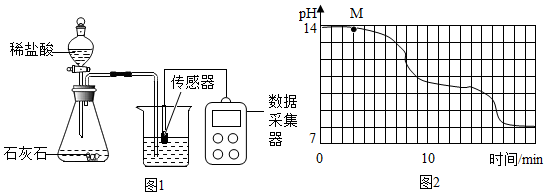
分析 (1)分液漏斗能够控制液体药品的流量,从而可以控制反应速率;
(2)pH大于7的溶液显碱性;
氢氧化钠溶液中通入二氧化碳时,二氧化碳和氢氧化钠反应生成碳酸钠和水;
(3)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
氢氧化钠溶液显碱性,能使酚酞试液变红色;
(4)实验过程中,发现18min后溶液的pH基本不再变化,说明反应生成的碳酸氢钠溶液已经达到饱和状态.
解答 解:(1)图1所示实验中,用“分液漏斗”而不用“长颈漏斗”其原因是控制稀盐酸滴入速率,从而控制二氧化碳生成速率.
故填:控制稀盐酸滴入速率,从而控制二氧化碳生成速率.
(2)通过图象分析可知,随着反应进行,溶液pH始终等于7,说明小苏打溶液显碱性;
图象中M点处发生的主要化学反应是:二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O.
故填:碱性;2NaOH+CO2=Na2CO3+H2O.
(3)为了确定M处溶液的成分,进行如下实验:①取M处少量溶液于试管中,加入足量氯化钙溶液,产生白色沉淀,说明溶液中含有碳酸钠;
②静置后向试管中滴加适量的酚酞试液,酚酞试液变红色,说明溶液中含有氢氧化钠,实验过程如下表所示:
| 实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
| ① | 加入足量氯化钙溶液 | 有白色沉淀 | 有碳酸钠和氢氧化钠 |
| ② | 滴入酚酞试液 | 酚酞试液变红色 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:计算题
| 体重 | 小于等于15千克 | 15~23千克 | 23~40千克 | 大于40千克 |
| 每次用量 | 30mg | 45mg | 60mg | 60mg |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. | 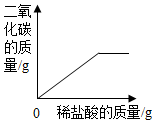 | D. | 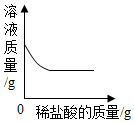 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 鱼类能在水中生活,证明氧气易溶于水 | |
| B. | 硫在氧气中燃烧,火焰呈淡蓝色 | |
| C. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| D. | 农家肥的腐熟,食物腐烂都是缓慢氧化的结果 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
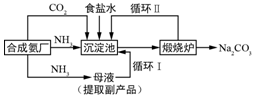
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A | 热胀冷缩是因为分子或原子的大小发生改变 |
| B | 美酒飘香,是由于分子在不断运动 |
| C | 冰冻三尺非一日之寒,水结冰时,分子静止不动 |
| D | 空气中的氧气、二氧化碳经混合,它们的化学性质改变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石蜡+氧气→点燃水+二氧化碳 | B. | 氧化汞$\stackrel{加热}{→}$汞+氧气 | ||
| C. | 过氧化氢$\stackrel{MnO_2}{→}$水+氧气 | D. | 铝+氧气$\stackrel{点燃}{→}$氧化铝 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
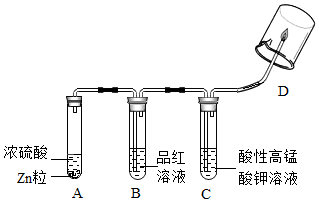
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com