
 Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH→A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀的现象,只能看到灰绿色沉淀.用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀.
Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH→A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀的现象,只能看到灰绿色沉淀.用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀.分析 Fe(OH)2遇到氧气会被氧气氧化成Fe(OH)3,所以在制取氢氧化亚铁时,要隔绝氧气,无论是方法一还是方法二都是隔绝氧气.
解答 解:蒸馏水中的氧气可以通过煮沸的方法除去.用不含氧气的蒸馏水配制好硫酸亚铁溶液为了隔绝氧气,用少量的植物油液封.
在方法二中铁与硫酸反应生成氢气,关闭止水夹,会使装置Ι中压强变大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁.
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
方法一:(1)煮沸;(2)少量植物油;(3)防止氧气进入溶液中或防止Fe(OH)2与O2
方法二:(3)在A处收集氢气进行验纯
H2SO4+2NaOH=Na2SO4+2H2O
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4.
点评 学会看图,能看懂题目中所给的装置图,每一部分的作用,只有这样才能明确反应是怎么进行的.


科目:初中化学 来源: 题型:推断题
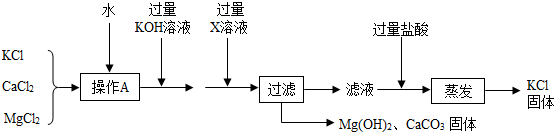
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气供给呼吸 | B. | 用氮气做食品包装袋的填充气 | ||
| C. | 用活性炭除去冰箱异味 | D. | 用碳素墨水写文字档案便于保存 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 冰中的水分子被冻住了,分子不在运动 | |
| B. | 剪断铜导线,铜原子可能被剪成了两半 | |
| C. | 吃“高钙片”后,钙元素可能会留在人体骨骼中 | |
| D. | 外星球上的甲烷分子与地球上的甲烷分子化学性质不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 参考如图信息 ,铁的相对原子质量为26 ,铁的相对原子质量为26 | |
| B. | 铁钉在潮湿的空气中容易生锈,因此钢铁的使用要注意防锈 | |
| C. | 生铁和钢是常见的铁合金 | |
| D. | 用赤铁矿高炉炼铁的化学反应方程式是Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
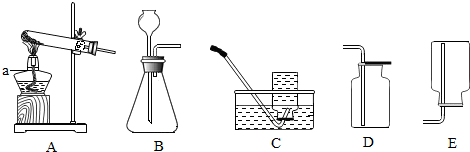
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 20 | 11 |
| 第2次 | 20 | 6 |
| 第3次 | 20 | 2.8 |
| 第4次 | 20 | n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com