
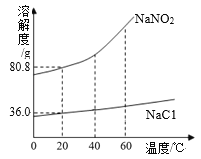
【题目】亚硝酸钠(NaNO2)是一种工业用盐,有毒、有咸味,外形与食盐相似。下图是NaNO2、NaCl 的溶解度曲线。请回答下列问题:
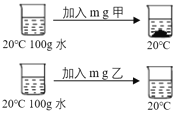
(1)根据溶解度曲线,某同学设计了鉴别 NaNO2、NaCl 固体的方案,如上图:
①由此可以判断甲是___(填化学式);
②m的取值范围为____。
(2)现有一杯125.0g溶质质量分数为20%的NaNO2溶液,若维持温度在20℃,要使该溶液变为饱和溶液,需要加入NaNO2固体____g。
(3)根据溶解度曲线,关于NaNO2和NaCl下列说法中正确的是____。
A 20℃时,等质量的两种固体加水配成饱和溶液,所得NaCl溶液的质量大
B 40℃时,NaNO2溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C 60℃时,两种物质的饱和溶液降温到 20℃时,NaNO2的溶液中析出晶体较多
D 除去NaNO2固体中混有的少量NaCl,可以采用降温结晶的方法
【答案】(1)①NaCl ②36.0<m≤80.8 (2)55.8 (3)AD
【解析】
(1)①20℃时,亚硝酸钠的溶解度大于氯化钠的溶解度,由此可以判断甲是NaCl;
②20℃时,亚硝酸钠的溶解度为80.8g,氯化钠的溶解度为36g,m的取值范围为36.0<m≤80.8。
(2)现有一杯125g、溶质质量分数为20%的NaNO2溶液,该溶液所含溶质的质量为125g×20%=25g; 若维持温度在20℃,此温度下NaNO2的溶解度是80.8g,所以要使该溶液变为饱和溶液,需要加入NaNO2的质量为80.8g-25g=55.8g;
(3)A 由图可知,20℃时,亚硝酸钠的溶解度大于氯化钠的溶解度,等质量的两种固体加水配成饱和溶液,氯化钠需要加水质量大,所得NaCl溶液的质量大,正确;
B 40℃时,没有说明溶液的状态是否饱和,不能判断NaNO2溶液的溶质质量分数大于NaCl溶液的溶质质量分数,故错误;
C 60℃时,等质量的两种物质的饱和溶液降温到 20℃时,NaNO2的溶液中析出晶体较多,故错误;
D 由图可知,氯化钠和亚硝酸钠的溶解度都随温度的升高而增大且亚硝酸钠的溶解度受温度影响大, 除去NaNO2固体中混有的少量NaCl,可以采用降温结晶的方法,正确;
故选AD。


科目:初中化学 来源: 题型:
【题目】水是宝贵的资源,请回答下列有关问题:
(1)建设新农村后,村民已经用上自来水,加入____可检验自来水是否为硬水,活性炭常用于净水,是利用其________,日常生活中通过____的方法可降低水的硬度,在洗碗时常加入洗涤剂,利用了洗涤剂的____作用。
(2)下列生活中常见物质与水混合,能形成溶液的是(___________)
A 蔗糖 B 乳胶漆 C 白酒 D 花生油
(3)氯化钠溶于水,难溶于植物油;氯化钠在热水中溶解的质量比在等质量的冷水中溶解的质量大,这说明物质的溶解能力与______和______有关。
(4)下列对水的描述正确的是____。
A 大量使用农药、化肥,不会造成水体污染
B 净化水程度最高的方法是蒸馏
C 硫粉在氧气中燃烧时,集气瓶中放少量水可吸收二氧化硫和热量
D 电解水时正极产生的气体体积比负极产生的气体体积大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究影响氯酸钾分解速率的因素,小红同学把实验温度恒定在330℃或380℃,(其他实验条件见下表),并设计了以下实验。
实验编号 | 氯酸钾的质量 | 其他物质的质量∕g | 温度∕℃ | 收集氧气的体积/mL | 反应所需时间∕s |
① | 2.0 | 330 | 100 | t1 | |
② | 2.0 | CuO 0.5 | 330 | 100 | t2 |
③ | 2.0 | MnO2 0.5 | 330 | 100 | t3 |
④ | 2.0 | MnO2 ____ | _______ | 100 | t4 |
请回答
(1)进行实验②和③,并对对比,其实验目的是____________________。
(2)要说明氧化铜对氯酸钾分解速率的影响,则要选用实验______和实验_______进行对比。
(3)用实验③和④探究温度对氯酸钾分解速率的影响,则MnO2的质量是__________g,反应的温度是_________℃,实验④发生反应的化学方程式为___________________;若t3>t4,氯酸钾分解速率与温度的关系是__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组做酸和碱的中和反应时,往NaOH溶液中滴入几滴酚酞溶液,发现溶液刚变
红瞬间又褪成无色。讨论并猜想。
猜想一:可能是酚酞溶液变质
猜想二:可能与NaOH溶液的浓度有关
猜想三:可能是酚酞溶液在滴入过程中被O2氧化
……
(1)甲同学认为猜想一是不对的。其理由是_________________________。
(2)取3mL不同浓度的NaOH溶液,分别滴入3滴酚酞溶液,观察现象。得到NaOH溶液的浓度与酚酞溶液褪色时间关系如图2所示。
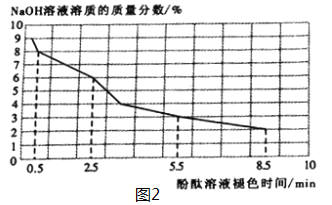
①根据图2所示,NaOH溶液溶质的质量分数________,酚酞溶液由红色褪为无色的时间越短。
②做酸和碱的中和反应时,滴加酚酞溶液的目的是________________________________。若用做实验的NaOH溶液溶质的质量分数为4%,完成该实验的操作时间应控制在_______之内。
(3)请设计实验,验证猜想三是否正确。
实验操作 | 实验现象 | 实验结论 |
__________ | 5.5min酚酞溶液褪色 | 酚酞溶液先变红后褪色与O2_______ (选填“有关”或“无关”) |
(4)探究酸碱中和反应时,逐滴加入稀盐酸的过程,并不断搅拌的目是_________________,写出该反应的化学方程式___________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我市有丰富的NaCl矿产资源,NaCl是一种重要的化工原料,可以用于生产烧碱、氯气等重要的化工产品。某化工厂购进一批以NaCl为主要成分的原料(假设杂质全部为CaCl2),化验员欲测定原料中NaCl的质量分数,先称取60.0g样品,加足量水充分溶解后,向所得溶液中加入足量的溶质质量分数为10%的Na2CO3溶液,充分反应后,生成2.0g白色沉淀。(已知:CaCl2+Na2CO3===2NaCl+CaCO3↓)
试回答下列问题(写出计算过程):
(1)原料中NaCl的质量分数是多少_____?
(2)当恰好完全反应时,需Na2CO3溶液的质量是多少_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】密闭容器中甲、乙、丙、丁四种物质在一定条件下发生化学反应,不同时刻的质量如表所示。
甲的质量/g | 乙的质量/g | 丙的质量/g | 丁的质量/g | |
反应前 | 64 | 10 | 1 | 16 |
t时刻 | 32 | a | b | c |
反应后 | 0 | 42 | d | 48 |
已知甲的相对分子质量为丁的2倍,下列有关说法错误的是( )
A. a为32
B. 该反应属于分解反应
C. 丙可能是催化剂
D. 该反应的化学方程式中甲与丁的化学计量数之比为1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的物质,这四种物质中均含有同一种元素。其中A为单质,B、C为氧化物,且B为有毒气体,D是一种建筑材料。它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略)
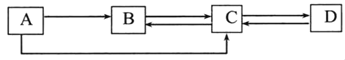
回答问题
(1)物质B的化学式为_____该物质在生产中的应用_____(写一条)
(2)物质B转化为物质C的反应中,_____(填“一定没有”、“可能有”或“一定有”)单质生成。物质C转化为物质B,该过程是_____(填“吸热反应”、“放热反应”)
(3)物质B和物质C的化学性质不同,理由是_____。
(4)物质C转化为物质D,该反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小型化工厂常以纯碱和大理石为主要原料,按以下工艺流程生产烧碱(NaOH).
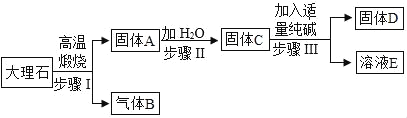
(1)物质C的化学式是_____没在步骤Ⅱ中要进行的分离操作是_____.
(2)写出步骤Ⅰ的化学方程式_____.
(3)写出步骤Ⅱ的化学方程式_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们生活在一个丰富多彩的物质世界中,人们的生产、生活与化学密不可分。
(1)请用适当的化学用语填空。
①地壳中含量最多的金属元素_____;②可用于炼钢的气体是_____;
③引起煤气中毒的主要物质_____;④汽水中含有的酸是_____。
(2)空气净化器已经走进我们的生活,它能够转化各种空气污染物(一般包括粉尘、异 味、甲醛之类的装修污染、细菌、过敏原等),有效提高空气清洁度。
①空气净化器的外壳有多种材料,其中一种是聚丙烯塑料,它属于_______ (填“金属材 料”,“合成材料”,“复合材料”),当外壳破裂时,不能用热修复的方法将其裂缝修补, 则该塑料属于 ___________ (填“热固性”,“热塑性”)塑料。
②空气净化器的净化技术有好多种,其中有利用活性炭网对空气进行初步“过滤”,这是因为活性炭具有_____。除此之外,还有利用光触媒催化转化的原理,利用 TiO2 作 催化剂,在光照条件下,将其中的甲醛(化学式为 HCHO)与氧气反应生成二氧化碳和水, 写出该化学反应的方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com