

| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
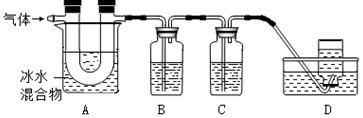
分析 (1)MgCO3与稀硫酸反应生成硫酸镁、水和二氧化碳;
(2)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(3)加氨水调节溶液的pH约为4,能使铁离子完全转化成氢氧化铁沉淀;
(4)硫是一种淡黄色固体;
二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,二氧化硫能和氢氧化钙反应生成亚硫酸钙沉淀和水,一氧化碳不能和氢氧化钙、碳酸钠、稀硝酸、高锰酸钾反应.
解答 解:(1)MgCO3与稀硫酸反应生成硫酸镁、水和二氧化碳,反应的化学方程式为:MgCO3+H2SO4═MgSO4+H2O+CO2↑.
故填:MgCO3+H2SO4═MgSO4+H2O+CO2↑.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为:2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
故填:2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)氢氧化铁沉淀的pH范围是1.5~3.2,加氨水调节溶液的pH约为4时,能使铁离子完全转化成氢氧化铁沉淀,反应的化学方程式为:Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
故填:使铁离子完全转化成氢氧化铁沉淀;Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓.
(4)①A中,硫蒸气通过冰水混合物时,会变成淡黄色固体,因此A中现象是:玻璃管壁出现淡黄色固体.
故填:淡黄.
②氢氧化钙溶液能够吸收二氧化碳和二氧化硫,因此B中盛放的溶液可以是氢氧化钙溶液,二氧化碳、二氧化硫通过B装置时,能和氢氧化钙反应生成碳酸钙沉淀和亚硫酸钙沉淀,因此实验现象为产生沉淀.
故填:a;产生沉淀.
③D中收集的气体是不能和氢氧化钙、碳酸钠、稀硝酸、高锰酸钾反应的CO.
故填:CO.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:选择题
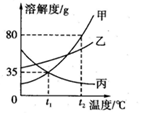
| A. | t2℃时,将50g甲物质加入到50g水中充分搅拌,得到100g甲的饱和溶液 | |
| B. | 将t2℃时甲、乙两种物质的饱和溶液降温到t1℃时,析出晶体的质量:甲>乙 | |
| C. | 将t1℃时三种物质的饱和溶液升温到t2℃时,所得溶液中溶质的质量分数的大小关系是:乙>甲=丙 | |
| D. | 用等质量的甲、乙、丙三种固体配置成t2℃时的饱和溶液,所得溶液质量的大小关系是:丙溶液>乙溶液>甲溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A.物质的分类 | B.资源的利用和保护 |
| ①合成橡胶、合金都属于合成材料 ②氧化物中含有氧元素 ③混合物中一定含有多种元素 | ①保护空气要减少有害气体和烟尘的排放 ②爱护水资源要节约用水和防止水体污染 ③保护金属资源只能通过防止金属腐蚀实现 |
| C.“低碳经济”的措施 | D.用“化学”眼光分析 |
| ①改造或淘汰高能耗、高污染产业 ②研制和开发新能源替代传统能源 ③减少使用一次性塑料方便袋 | ①洗涤剂去油污是因为洗涤剂具有乳化功能 ②湿衣服晾干是因为分子之间有间隔 ③明矾净水是因为明矾溶于水生成胶状物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 中和反应有盐和水生成,所以有盐和水生成的化学反应一定是中和反应 | |
| B. | 单质只含一种元素,所以含一种元素的物质一定是单质 | |
| C. | 复分解反应前后,组成各物质的所有元素的化合价一定不变 | |
| D. | 氧化物中含有氧元素,含有氧元素的化合物一定是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 地壳中含量最多的金属元素是铁元素,微量硒元素可以防癌,过量的硒会致癌 | |
| B. | 误服重金属盐中毒,马上服用蛋清可减轻毒性稀释浓硫酸时,要把水注入浓硫酸中 | |
| C. | 我国化学家张青莲创造了“联合制碱法”俄国科学家门捷列夫发现了元素周期律 | |
| D. | 对化石燃料进行综合开发可提高其利用率,氢气燃烧放热多、无污染,被称为“绿色能源” |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com