
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:初中化学 来源: 题型:阅读理解
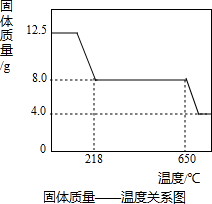 某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).
某企业是一家以生产电缆类产品为主的地方明星企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4?5H2O).

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 请根据下面有关信息,按题目要求回答问题:
请根据下面有关信息,按题目要求回答问题:
| ||
. |
| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水质量/g | 硫酸甲 | 1.6 | 2.2 | 5.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 硫酸乙 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
SO42- SO42- |
取少量滤液,加入硝酸钡溶液,若有白色沉淀产生,说明溶液中含有SO42-;若无白色沉淀产生,说明溶液中不含有SO42-. 取少量滤液,加入硝酸钡溶液,若有白色沉淀产生,说明溶液中含有SO42-;若无白色沉淀产生,说明溶液中不含有SO42-. |
查看答案和解析>>
科目:初中化学 来源:中学学习一本通 化学 九年级下册 人教课标 题型:022
从200 mL质量分数为60%(密度为1.5 g/cm3)的硫酸溶液中取出50 mL,那么这50 mL硫酸中所含溶质的质量是________g,将这50 mL硫酸稀释成质量分数为20%的稀硫酸需加水________mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com