
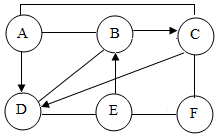
 现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)
现有A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,且B气体在同等条件下是密度最小的气体,C常用作导线的内部材料,C和D含有相同元素,E是一种溶液,溶质是由两种元素组成的化合物,用两圆间的“──”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质.请回答下列问题:(以上反应均在初中知识范围内)分析 根据A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,B气体在同等条件下是密度最小的气体,所以B是氢气,C常用作导线的内部材料,所以C是铜,C和D含有相同元素,所以D是氧化铜,E是一种溶液,溶质是由两种元素组成的化合物,E会与氧化铜反应,所以E是盐酸,A会转化成氧化铜,所以A是氧气,F会与盐酸、铜反应,所以F是硝酸银,然后将推出的物质进行验证即可.
解答 解:(1)A、B、C、D、E、F六种初中化学常见的物质,在常温下A、B为气体单质,B气体在同等条件下是密度最小的气体,所以B是氢气,C常用作导线的内部材料,所以C是铜,C和D含有相同元素,所以D是氧化铜,E是一种溶液,溶质是由两种元素组成的化合物,E会与氧化铜反应,所以E是盐酸,A会转化成氧化铜,所以A是氧气,F会与盐酸、铜反应,所以F是硝酸银,经过验证,推导正确,所以C是Cu;
(2)A与B的反应是氢气和氧气在点燃的条件下生成水,化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
(3)E转化为B的反应是铁和盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl═FeCl2+H2↑;
(4)足量的片状C与F的反应是铜和硝酸银反应生成硝酸铜和银,实验现象为:紫红色固体表面有银白色物质析出,溶液的颜色由无色变成蓝色.
故答案为:(1)Cu;
(2)2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
(3)Fe+2HCl═FeCl2+H2↑;
(4)紫红色固体表面有银白色物质析出,溶液的颜色由无色变成蓝色.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.


科目:初中化学 来源: 题型:选择题
| A. | 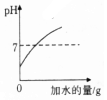 向pH=1的溶液中不断加水 | |
| B. |  一定量的稀盐酸与镁粉反应 | |
| C. |  向HCl和MgCl2混合液中滴加NaOH溶液 | |
| D. |  加热木炭和氧化铜的混合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
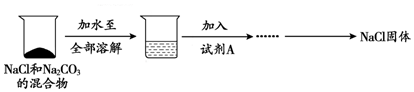
| 加入试剂A | 测得数据 | |
| 甲组方案 | 过量CaCl2溶液 | CaCO3沉淀5g |
| 乙组方案 | 适量稀硫酸 | CO2气体2.2g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质一定都是由分子构成的 | |
| B. | 常温下pH大于7的溶液一定是碱性溶液 | |
| C. | 氧化物中一定含有氧元素 | |
| D. | 酸与碱作用生成盐和水的反应一定是中和反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 剩余固体为纯净物 | |
| B. | 反应过程中,溶液逐渐变蓝 | |
| C. | 原固体混合物中Cu的质量大于Cu2O | |
| D. | 在最后一次洗涤后的滤液中滴加BaCl2溶液,检验固体是否洗涤干净 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气能支持燃烧,可用于气焊 | |
| B. | 干冰升华时吸收热量,可用于人工降雨 | |
| C. | 活性炭有吸附性,它可应用于雾霾天专用口罩中 | |
| D. | 因超导体的电阻为零,用它制作灯丝会使灯丝特别亮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com