
下面是某兴趣小组同学做的2个小实验。根据实验内容回答下列问题(仪器的固定装置已经省略)。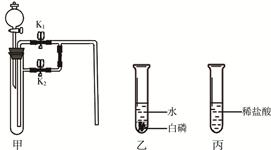
(1)若甲中盛有二氧化锰,连接甲乙装置,关闭K1打开K2,从分液漏斗向甲中加入适量双氧水,关闭分液漏斗活塞,观察到乙中导管口有气泡冒出,白磷不燃烧;关闭K2打开K1,则乙中的现象是 ,且白磷燃烧。
①甲中发生反应的化学方程式是 。
②实验过程中,白磷产生现象差异的原因是 。
(2)若甲中充满二氧化碳(K1、K2关闭),连接甲丙,从分液漏斗向甲中加入适量的澄清石灰水,关闭分液漏斗活塞,一段时间后,打开K1,整个实验过程中观察到甲中的现象是 。
科目:初中化学 来源: 题型:探究题
二十一世纪是海洋开发与利用的世纪,我市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。以下是某研究性学习小组在探究海水综合利用中遇到的问题,请你参与解决并填空:
问题一、海水制镁过程中如何富集镁离子?
甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳。
乙:高温加热蒸发海水后,加入石灰乳。
丙:向晒盐后的卤水中,加入石灰乳。
通过分析比较,你认为 ① 的设想最为经济合理(选填“甲”、“乙”或“丙”)。
问题二、粗盐纯化过程中如何除去可溶性杂质?
粗盐中含有硫酸钠、氯化钙等杂质。提纯时,先向粗盐水中加过量的氢氧化钡溶液,目的是完全除尽硫酸钠;再加过量的碳酸钠溶液,除去杂质阳离子;滤去沉淀,向滤液中加入 ② ,将溶液的pH调为7,即得到精盐水。
问题三、海水“制碱” 的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行了如下探究:
【提出猜想】
甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中含有碳酸钠和氢氧化钠;
丙的猜想:样品中只含有氢氧化钠。
他们做出上述三种猜想的科学依据是 ③ 。
【实验、记录与分析】
| 步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量样品于试管中,加水完全 溶液,再加入过量 ④ | 生成白色沉淀 | 丙的猜想 不成立 |
| 2 | 取步骤1反应后的溶液于试管中 ⑤ | ⑥ | 只有甲的 猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小芳同学从超市购买了一瓶维生素C泡腾片。下图是标签上的部分内容。
| 维生素C泡腾片 功能:补充人体维生素C,增强机体抵抗力 主要成分:维生素C 辅料成分:碳酸氢钠、氯化钠、酒石酸晶体、蔗糖、糖精钠、阿朴胡萝卜醛、橘味香精、橙味香精、维生素B 贮藏:低温、避光、防潮 |
| 实验步骤 | 实验现象 | 实验结论 |
| 将一片维生素C泡腾片放入水中,将产生的气体通入__ __________________ | | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
科学家提出工业生产回收利用空气中CO2的构想:把空气吹入饱和碳酸钠溶液中,溶液可吸收CO2生成碳酸氢钠;加热碳酸氢钠固体又分解放出CO2;在合成塔内CO2与氢气反应生成甲醇(CH3OH)和水。简要的生产流程如下图所示:
[资料卡片] 碳酸氢钠分解温度是270℃,碳酸钠在856℃熔化,但还未达到分解温度。
请回答下列问题:
(1)吸收池中发生了化合反应,化学方程式为 。
(2)回收利用空气中的CO2,降低大气中CO2浓度,有利于减缓 。
(3)合成塔中发生反应的化学方程式为 。
(4)该流程中能循环利用的物质是 (填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某同学设计如图所示的实验装置,进行一氧化碳还原氧化铜的实验。试回答: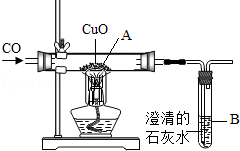
(1)该装置存在的一个主要问题是 :改进措施是 。[来源:学科(2)实验开始时,是先加热氧化铜,还是先通入一氧化碳? ,目的是为 。
(3)实验过程中,图中A处观察到的实验现象是 ;A处发生反应的化学方程式为 ;B处观察到的实验现象是 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
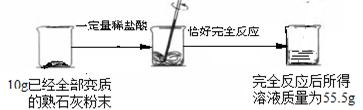
某化学兴趣小组的同学对一瓶久置的熟石灰粉末的组成进行实验探究,请你一起参与他们的探究活动。
[提出问题]这瓶熟石灰粉末是否已经变质生成了CaCO3?
[进行猜想]猜想一: 。
猜想二:熟石灰部分变成了CaCO3。
猜想三:熟石灰没有变质。
[设计实验]该小组同学对猜想一设计了下列探究方案,请你帮助他们完成下表中相关实验内容。
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样,加适量水,搅拌,过滤 ②取少量滤液于试管中,滴入酚酞试液 ③取少量滤渣于试管中,加入盐酸 | ②无明显变化。 ③ 。 | 猜想一成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2,下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题:
【查阅资料】:
1、NH4Cl和NaNO2反应生成NaCl、H2O及N2,并放出大量热量;
2、20℃时,NH4Cl的溶解度约为37g;
3、N2难溶于水,实验条件下,密度为1.25g·L—1。
【实验步骤】:
① ;
②20℃时,取0.78g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为V mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】:
(1)写出装置中仪器的名称:a、 ;b、 ;
(2)反应的化学方程式为: ;
(3)完善实验步骤中的所缺部分:① ;
(4)步骤④中,移走酒精灯的目的是 ;
(5)NH4Cl是一种 (填“易溶”、“可溶”、“微溶”、“难溶”)物质。20℃时,其饱和溶液中溶质质量分数为 。根据实验数据计算,生成氮气约为多少毫升?(3分,计算过程中,中间数据保留2位小数,最终结果为整数;相对分子质量:Mr-NH4Cl:53.5、Mr-N2:28)
(6)根据计算结果,步骤⑥中V的数值为 ;
(7)实验中,实际测得氮气的体积偏大,可能原因是 。
A.实验中加入饱和NaNO2溶液的体积也被作为生成N2的体积
B.装置漏气
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某研究小组欲检验草酸晶体样品分解产物,并测定样品中草酸晶体的质量分数(假设杂质不参与反应)。已知:浓硫酸可作为干燥剂;草酸晶体(H2C2O4·2H2O )的性质见下表:
| 熔点 | 沸点 | 热稳定性 | 其他 |
| 101℃~102℃ | 150℃~160℃升华 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 与 Ca(OH)2反应产生白色沉淀(CaC2O4) |

查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图,装置气密性良好),一段时间后,发现装置中右侧导管中的液面升高,铁钉生锈,试管底部有黑色固体物质
[提出问题]导管中液体为何升高?黑色固体物质又是什么?
[猜想与假设]
该黑色固体可能含有:①Fe、②Fe2O3、③FeCl3、④C四种物质
[猜想分析]
①影响右侧导管中的液面升高的物质是
②不可能含有氯化铁,理由是
③一定含有碳,理由是
[实验验证]
①验证黑色固体中一定含有碳所选用的试剂是
②检验黑色固体中是否含有铁的实验方法是
结论:铁钉在食盐水中比在纯水中生锈快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com