

分析 (1)根据锌粒与稀盐酸反应生成氯化锌和氢气进行分析;
(2)根据碱石灰的成分和其中物质的性质分析解答;
(3)根据钙和氢气在加热的条件下生成氢化钙进行分析;
(4)根据检查装置气密性的方法和题目要求分析解答;
(5)根据装置特点和氢化钙与水反应生成氢气进行分析;
(6)根据氢气的体积等于反应前后液面差进行分析;
(7)根据氢气的质量=氢气的体积×氢气的密度求出氢气的质量,再结合氢化钙与水反应方程式及钙与水反应方程式,求出氢化钙的质量,进而计算样品中氢化钙的纯度.
解答 解:(1)锌粒与稀盐酸反应生成氯化锌和氢气,反应的方程式是:Zn+2HCl=ZnCl2+H2↑;
(2)碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体;
(3)钙和氢气在加热的条件下生成氢化钙,方程式是Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(4)要检查该套装置的气密性,可以将活塞关闭后,往分液漏斗中加入适量的水,然后用手指堵住装置D的导管口,打开活塞,观察分液漏斗内的液面变化判断装置是否漏气;
(5)由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(6)氢气的体积等于反应前后液面差,为:110.0mL-10.0mL=100.0mL;
(7)反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg
设样品中氢化钙的质量是X,生成氢气质量为Y,则钙的质量为100mg-X,钙与水反应生成氢气质量为9mg-Y则
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
$\frac{42}{4}=\frac{X}{Y}$,解得Y=$\frac{4X}{42}$
Ca+2H2O═Ca(OH)2+H2↑
40 2
100mg-X 9mg-Y
$\frac{40}{2}=\frac{100mg-X}{9mg-Y}$
将Y=$\frac{2X}{21}$代入,解得X=88.4mg
所以样品中氢化钙的纯度为:$\frac{88.4mg}{100mg}$×100%=88.4%.
故答案为:(1)Zn+2HCl=ZnCl2+H2↑;
(2)吸收水蒸气和部分氯化氢气体;
(3)Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(4)将活塞关闭后,往分液漏斗中加入适量的水,用手指堵住装置D的导管口,打开活塞,若气密性良好,可观察到分液漏斗内的液面几乎不下降;
(5)量气管中液面不再变化;
(6)100;
(7)88.4%.
点评 本题考查内容全面而综合,解答时要根据相关知识细心分析解答,尤其是计算题,能很好的考查学生对知识的掌握和应用能力.


科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸不小心沾到皮肤上,先用干布拭去,再立刻用稀NaOH溶液冲洗 | |
| B. | 称量氢氧化钠固体时,必须将所称药品放在托盘天平左盘上的洁净的纸上 | |
| C. | 为了测定某溶液的pH值,将干燥的pH试纸浸入待测溶液片刻后取出,再与标准比色卡进行对比 | |
| D. | 燃着的酒精灯打翻后在桌面上引起燃烧,不能用水扑灭,应立即用沙子或湿抹布覆盖 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 鉴别CO和CO2 | 通入澄清的石灰水或闻气味 |
| B | 鉴别硬水和软水 | 观察颜色 |
| C | 除去生石灰中杂质石灰石 | 加水或加稀盐酸 |
| D | 除去氧化铜中碳粉 | 在空气中灼烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
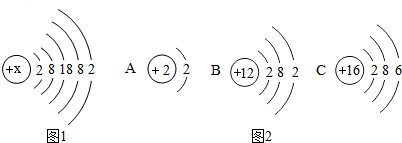
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
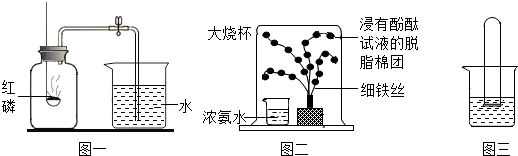
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气能支持燃烧,可以作燃料 | |
| B. | 稀有气体有不同的颜色,可用作电光源 | |
| C. | 氮气化学性质不活泼,可用作保护气 | |
| D. | 石墨具有润滑性,可用作铅笔芯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com