


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| 盐溶液 | NaCl | Na2CO3 | CaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样品溶于水配成溶液,向溶液中滴加CaCl2溶液至过量,充分反应后,静置. | 产生白色沉淀 | 说明久置固体中一定含有 Na2CO3 Na2CO3 (填化学式,下同). |
| ②用玻璃棒蘸取少量①的上层清液滴在pH试纸上,与标准比色卡对照. | pH=11 | 说明上述猜想中 猜想② 猜想② 是正确的. |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
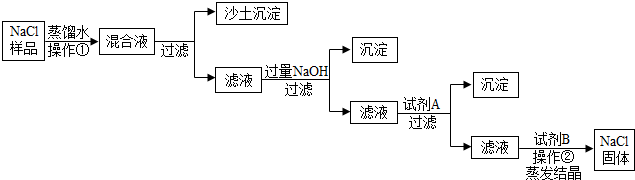

查看答案和解析>>
科目:初中化学 来源:郴州 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com