
下列物质充分混合后所得混合物是否为溶液?若是溶液的,写出该溶液中溶质的化学式.
(1)CaCO3溶于适量的稀盐酸中.
(2)CaCO3溶于适量的水中.
(3)锌投入过量的稀H2SO4中.
(4)NaOH溶液与CuSO4溶液按适当比例混合,使其恰好完全反应后静置,过滤出沉淀.
|
答案:(1)是溶液,溶质是CaCl2. (2)不是溶液. (3)是溶液,溶质是ZnSO4和H2SO4. (4)是溶液,溶质是Na2SO4. 分析:判断所得混合物是否为溶液,关键是要正确理解溶液的概念及物质发生反应的实质.(1)中CaCO3与稀盐酸反应生成CaCl2、H2O和CO2气体,CaCO3溶于适量的稀盐酸,意味着二者恰好完全反应,所得溶液是CaCl2溶液,溶质是CaCl2. (2)中CaCO3不溶于水,从而得不到溶液.(3)中发生反应:Zn+H2SO4 |


科目:初中化学 来源: 题型:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g/100g水) |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
 根据下表回答问题.
根据下表回答问题.| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g/100g水) |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
查看答案和解析>>
科目:初中化学 来源:2013届江苏省仪征市大仪中学九年级上学期末考试化学试卷(带解析) 题型:填空题
(8分)根据下表回答问题。
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g/100g水) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |

查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省仪征市九年级上学期末考试化学试卷(解析版) 题型:填空题
(8分)根据下表回答问题。
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度 (g/100g水) |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
⑴ 40℃时,氯化钠固体的溶解度是 g/100g水。
⑵ 60℃时在100g水中加入100g硝酸钾固体,充分溶解后所形成的溶液是 溶液(“饱和”或“不饱和”)。
⑶ 将上述⑵中溶液降温到20℃时,析出的晶体质量是 g.
⑷ 工业上将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温,析出晶体。
①析出的晶体中主要物质是 ;
②关于剩余溶液.下列说法正确的是 (填序号);
A.只含氯化钠,不含硝酸钾
B.含有氯化钠,又含有硝酸钾,且只有硝酸钾达到饱和
C.含有氯化钠,又含有硝酸钾,且两者都达到饱和
⑸ 20℃时,将18克氯化钠溶解在80克水中,应至少蒸发 g 水才能形成饱和溶液。蒸发时要用到玻璃棒,其作用是 。
A.搅拌促进溶解 B.加速蒸发
C.防止液滴飞溅 D.引流缓冲
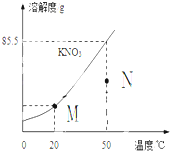
⑹右图为硝酸钾的溶解度曲线。M、N两点分别表示硝酸钾的两种溶液。下列做法能实现M、N间的相互转化的是
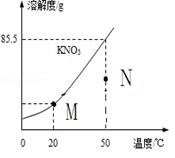
A.从M→N:先将M升温再将其蒸发掉部分水
B.从M→N:先将M升温再将加入适量固体硝酸钾
C.从N→M:先将N降温再加入适量固体硝酸钾
D.从N→M:先过滤出适量固体硝酸钾再降温
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省扬州市仪征市大仪中学九年级(上)期末化学试卷(解析版) 题型:填空题
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度 (g/100g水) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com