考点:元素周期表的特点及其应用,金属的物理性质及用途,金属的化学性质,从组成上识别氧化物,纯净物和混合物的判别,物质的相互转化和制备,原子的有关数量计算,碳的化学性质,反应类型的判定,质量守恒定律及其应用,书写化学方程式、文字表达式、电离方程式
专题:物质的微观构成与物质的宏观组成,化学用语和质量守恒定律,物质的分类,碳单质与含碳化合物的性质与用途
分析:(1)元素周期表中可以得到有关元素的一些内容:元素符号、原子量、原子序数等;根据原子的最外层电子数确定得失电子情况;
(2)有两种元素组成,其中一种是氧元素的化合物是氧化物;
(3)根据反应物和生成物的情况确定反应类型;
(4)根据金属铝的导电性、导热性和延展性来回答;
(5)合金是不同金属元素或是金属元素的单质的混合物;
(6)原子的核外电子数=核电荷数=原子序数=质子数;
(7)根据化合价规则计算元素的化合价;
(8)石墨烯是碳元素组成的物质,在空气中完全燃烧生成水以及二氧化碳;
(9)“烯合金”中含有金属铝,放入足量稀硫酸中,能和硫酸之间反应生成硫酸铝和氢气;
(10)据信息:二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物水,据此书写方程式;
②根据反应的条件结合反应物和产物来回答;
③根据方程式中元素守恒来确定物质.
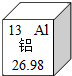
解答:解:(1)根据元素周期表的应用:从中可以得到Al元素的相对原子量为26.98,铝原子最外层有3个电子,少于4个,易失去电子,故答案为:26.98;失去;
(2)氧化铝有两种元素组成,其中一种是氧元素,属于是氧化物,故答案为:B;
(3)2Al
2O
3 4Al+3O
2↑是一种反应物生成两种产物的反应,属于分解反应,故答案为:分解;
(4)金属铝的导电性、导热性和延展性,用作厨具,体现的是导热性,故答案为:导热;
(5)合金是不同金属元素的单质或是金属元素和非金属元素的单质组成的混合物,故答案为:混合物;
(6)一个氦原子的原子核内有2个质子,核外电子数=核电荷数=原子序数=质子数=2,故答案为:2;
(7)钛酸亚铁(FeTiO
3)中氧元素是-2价,铁元素是+2价,所以根据化合价规则,钛元素是+4价,故答案为:+4价;
(8)石墨烯是碳元素组成的物质,在空气中完全燃烧生成水以及二氧化碳,方程式为:C+O
2CO
2,故答案为:C+O
2CO
2;
(9)根据信息:石墨烯与铝合金在全球率先研制出“烯合金”,则可以确定“烯合金”中含有金属铝,烯合金放入足量稀硫酸中,能和硫酸之间反应生成硫酸铝和氢气,方程式为:2Al+3H
2SO
4═Al
2(SO
4)
3+3H
2↑,故答案为:2Al+3H
2SO
4═Al
2(SO
4)
3+3H
2↑;
(10)根据信息:二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH
4O)外,还生成一种常温下为液态的化合物,根据元素守恒,该物质即为水,方程式为:CO
2+3H
2CH
4O+H
2O;
②A.该技术中,碳原子全部转化为甲醇,符合低碳经济的理念,故A正确;
B.水生成氢气的过程中所用的催化剂不一定是二氧化锰,还可以选择其他的,故B错误;
C.二氧化碳循环利用,该技术有助于缓解全球面临的能源危机,故C正确.
故选AC;
③根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前C、O原子个数是1、2;反应后C、O、N、H原子个数是1、2、2、6,故物质M的化学式为NH
3,故答案为:NH
3.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力,难度大.

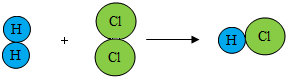
 控制化学反应的条件可以促进或抑制化学反应,更好使化学反应为人类造福.
控制化学反应的条件可以促进或抑制化学反应,更好使化学反应为人类造福.


 ”和“
”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( )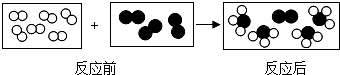
 ”和“
”和“ ”分子的个数比是3:1
”分子的个数比是3:1