
| A. | K+ H+ SO42- OH- | B. | Na+ Ca2+ CO32- NO3- | ||
| C. | Na+ Cl- NO3- Ag+ | D. | Na+ Cu2+ Cl- SO42- |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 用甲醛溶液浸泡海产品,实现对产品的保鲜 | |
| B. | 工业盐有咸味,可用于腌制食品 | |
| C. | 超市里所有食品都不含食品添加剂 | |
| D. | 不吃霉变的花生等食物,因为食物霉变产生的黄曲霉素有毒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
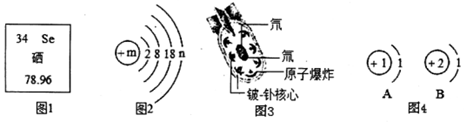
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
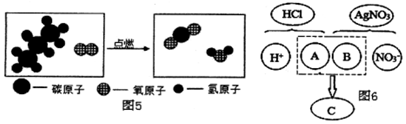
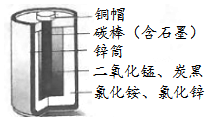 如图是普通干电池内部各部分结构图,用化学用语表示下列带点文字部分.
如图是普通干电池内部各部分结构图,用化学用语表示下列带点文字部分.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
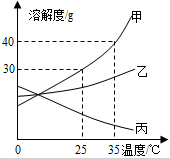
 如图是固体物质甲的溶解度曲线.
如图是固体物质甲的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 第一周期 | 1 H | 2 He | ||||||
| 第二周期 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne |
| 第三周期 | 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18 Ar |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com