
| 浓度时间催化剂 | 30%H2O2溶液 | 15% H2O2溶液 | 5% H2O2溶液 |
| 加入WgMnO2 | 0.2 | 0.8 | 2.0 |
| 加入WgFe2O3 | 7.0 | 9.0 | 16.0 |
分析 【实验验证】根据过氧化氢溶液中伸入带火星的木条,没有复燃,说明产生氧气速度慢,加入氧化铁后,带火星木条复燃,说明氧化铁加快了反应速度;
【实验结论】根据反应物,生成物书写文字表达式;
【反思评价】催化剂在反应前后本身质量和化学性质都不变,所以不仅考虑反应前后氧化铁质量不变,还需要考虑化学性质;
【拓展】根据对比实验数据可知相同条件下,MnO2的催化效果比Fe2O3好(或相同条件下,H2O2浓度越大,反应越快)进行解答;
解答 解:【实验验证】在实验一的试管中过氧化氢溶液中伸入带火星的木条,没有复燃,说明产生氧气速度慢;实验二中加入Wg 氧化铁粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃,说明加入氧化铁后产生氧气的速度加快了很多,说明氧化铁加快了过氧化氢分解的速度;实验三将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为Wg,说明了反应前后氧化铁质量不变;
【实验结论】氧化铁粉末可以作为过氧化氢分解的催化剂.该反应文字表达式为:过氧化氢$\stackrel{氧化铁}{→}$水+氧气;
【反思评价】催化剂在反应前后本身质量和化学性质都不变,所以不仅考虑反应前后氧化铁质量不变,还需要考虑化学性质是否改变;
【拓展】分析表格数据可知:当双氧水浓度相同时,向其中加入等质量的二氧化锰和三氧化二铁,发现生成等量的氧气所需要的时间是不同的,加二氧化锰的双氧水产生氧气的速率快;
故答案为:【实验验证】产生氧气速度慢;氧化铁加快了过氧化氢分解的速度;反应前后氧化铁质量不变;
【实验结论】过氧化氢$\stackrel{氧化铁}{→}$水+氧气;
【反思评价】探究反应前后氧化铁的化学性质不变;
【拓展】相同条件下,MnO2的催化效果比Fe2O3好(或其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快);
点评 解答本题关键是要知道催化剂在反应前后本身质量和化学性质都不变,催化剂一定能加快反应速度.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
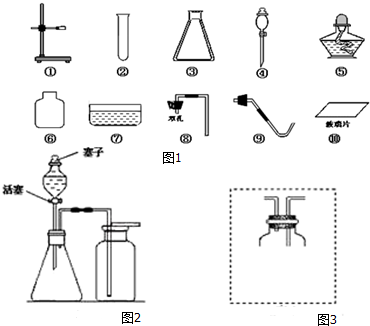
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 端午阳节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH固体,由此,激发了她的探究欲望
端午阳节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH固体,由此,激发了她的探究欲望| Na2CO3的质量/g | 5.3 |
| 变质的NaOH的质量/g | 4.0 |
| NaOH的变质程度(用质量分数表示) | 33.3% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
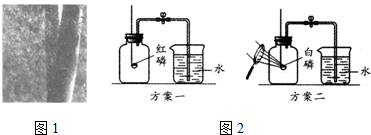
| 实验步骤 | 实验现象 | 实验结论及解释 |
| 将所取气体 倒入澄清石灰水,振荡 | 澄清石灰水立刻变浑浊 | 有二氧化碳. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com