
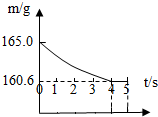
 在烧杯中加入NaCl和NaHCO3的固体混合物10.0g后,再加入68.9g 稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.试计算:
在烧杯中加入NaCl和NaHCO3的固体混合物10.0g后,再加入68.9g 稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.试计算: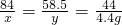
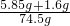 ×100%=10%
×100%=10% 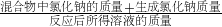 ×100%,根据反应计算出反应生成的氯化钠质量、根据质量守恒计算反应后溶液的质量.
×100%,根据反应计算出反应生成的氯化钠质量、根据质量守恒计算反应后溶液的质量.

 互动英语系列答案
互动英语系列答案科目:初中化学 来源: 题型:
| 次数物质的质量 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
| 生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |

查看答案和解析>>
科目:初中化学 来源: 题型:
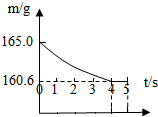 在烧杯中加入NaCl和NaHCO3的固体混合物10.0g后,再加入68.9g 稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.试计算:
在烧杯中加入NaCl和NaHCO3的固体混合物10.0g后,再加入68.9g 稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
(2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:查看答案和解析>>
科目:初中化学 来源:2009年江苏省无锡市育才中学中考化学一模试卷(解析版) 题型:解答题
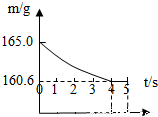 在烧杯中加入NaCl和NaHCO3的固体混合物10.0g后,再加入68.9g 稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.试计算:
在烧杯中加入NaCl和NaHCO3的固体混合物10.0g后,再加入68.9g 稀盐酸恰好完全反应.反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示.试计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com