
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:初中化学 来源: 题型:阅读理解
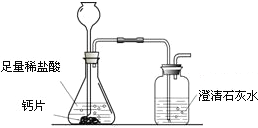 (4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
查看答案和解析>>
科目:初中化学 来源:2013-2014学年福建省九年级下学期竞赛选拔化学试卷(解析版) 题型:计算题
将3.6g 碳酸钙高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,求固体混合物中氧化钙的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com