
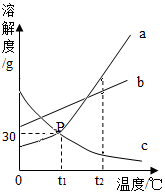
 如图是a、b、c三种物质(不含结晶水)的溶解度曲线,a与c的溶解度曲线交于P点,请据图回答
如图是a、b、c三种物质(不含结晶水)的溶解度曲线,a与c的溶解度曲线交于P点,请据图回答分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,P点的含义是:t1℃时,a、c物质的溶解度相等;
(2)t1℃时,b物质的溶解度最大,a、c物质的溶解度相等,升高温度,a、b物质不会析出晶体,c物质会析出晶体,所以将t1℃时a、b、c三种物质的饱和溶液温度升高到t2℃时,三种溶液的溶质质量分数大小关系是b>a>c,故选:D.
故答案为:(1)t1℃时,a、c物质的溶解度相等;
(2)D.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.
实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.| 实验一 | 实验二 | 实验三 | |
| 反应前稀盐酸+烧杯质量(克) | 150 | 150 | 150 |
| 反应前固体样品质量(克) | 4 | 8 | 12 |
| 反应后烧杯内物质+烧杯质量(克) | m | 155.8 | 158.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 性质 |
| A | 石墨 | 电池电极 | 石墨很软 |
| B | CO | 冶炼金属 | CO有可燃性 |
| C | 熟石灰 | 改良酸性土壤 | 熟石灰显碱性 |
| D | 小苏打 | 治疗胃酸过多 | 小苏打易分解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子的质量和体积都很小 | B. | 温度升高,分子的体积变大 | ||
| C. | 分子在不停地运动 | D. | 温度越高,分子运动速率越快 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
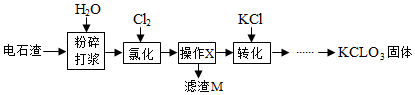
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入几滴无色酚酞试液; | 观察到溶液变红色现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到固体溶解并有气泡产生现象 | 猜想③正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com