
在一密闭容器中,有甲、乙、丙、丁四种物质,反应前,他们的质量如白色条形图所示.反应结束后,他们的质量如黑色条形图所示.下列说法正确的是( )
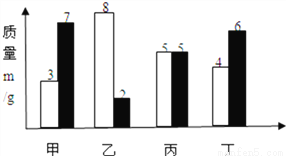
A. 丙一定是该反应的催化剂
B. 该反应为化合反应
C. 甲、乙的相对分子质量之比一定为2:3
D. 反应过程中甲和丁变化的质量比为2:1
D 【解析】试题分析:,依据图示:反应前后质量增加的为甲、丁,减少为乙,不变的为丙,故.丙可能是该反应的催化剂,A错误;该反应为反应分解,B错误;甲、乙的相对分子质量之比不一定为2:3,C错误;反应过程中甲和丁变化的质量比为(7-3):(6-4)=2:1,D正确。 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源:云南民族大学附属中学2018届九年级下学期第二次月考化学试卷 题型:填空题
用适当的化学符号和数字回答:




查看答案和解析>>
科目:初中化学 来源:吉林省2018年九年级化学中考模拟试卷 题型:流程题
五氧化二钒(V2O5)是种工业催化剂,如图是制取的工艺流程。

(1)写出反应Ⅰ的化学方程式为_____________________;操作a的名称是___________。
(2)反应Ⅱ的基本反应类型______________。
(3)物质X中一定含有的元素是__________(用元素符号表示)。
(4)写出副产物KCl的一种用途______________________(用10个左右的文字表示)。
KVO3+NH4Cl=NH4VO3↓+KCl 过滤 分解反应 N 农业上用作钾肥 【解析】根据所学知识和题中信息知,(1)反应Ⅰ的化学方程式为KVO3+NH4Cl=NH4VO3↓+KCl;操作a的名称是过滤,过滤是把不溶于液体的固体物质与液体分离的一种方法。(2)反应Ⅱ的基本反应类型分解反应,一种物质分解生成了三种物质,属于分解反应。(3)根据质量守恒定律知,物质X中一定含有的元素是N。(4...查看答案和解析>>
科目:初中化学 来源:山东省烟台龙口市2017-2018学年八年级下学期期中考试化学试卷 题型:综合题
甲醇(CH3OH)有毒,误饮可使眼睛失明,甚至死亡.最新研究证明用氨气(NH3)处理含有甲醇的工业废水,使其转变成无毒的物质.有关反应的化学方程式为: 5CH3OH+12O2+6NH3 3B+5CO2+19H2O
3B+5CO2+19H2O
(1)上述反应中B物质的化学式为________ ,反应中生成的二氧化碳和水的质量比是_______,甲醇中氧元素的质量分数为___________ 。
(2)若处理含有0.32%甲醇的工业废水500吨,理论上需要氨气________吨?
N2 110:171 50% 1.02吨 【解析】(1)反应中B物质的化学式要依据质量守恒定律,反应前后原子种类、个数不变,进行推断;根据化学式计算组成元素的质量分数的基础计算;(2)利用化学方程式5CH3OH+12O2+6NH33N2+5CO2+19H2O,由反应物甲醇的质量计算反应物氨气的质量。(1)反应前碳、氢、氧、氮原子个数为10,38,29,6;反应后碳、氢、氧、氮原子个数为10,...查看答案和解析>>
科目:初中化学 来源:山东省烟台龙口市2017-2018学年八年级下学期期中考试化学试卷 题型:单选题
现有16克某可燃物在密闭容器中完全燃烧后,测得生成44克二氧化碳和36克水,关于该可燃物的说法正确的是( )
A. 一定是氧化物 B. 只含有碳、氢两种元素
C. 一定含有碳、氢、氧三种元素 D. 一定含有碳、氢元素,可能含有氧元素
B 【解析】参加反应的氧气质量为44g+36g﹣16g=64g,44g二氧化碳中碳元素的质量为44g××100%=12g,氧元素的质量为44g﹣12g=32g,36g水中氢元素的质量为36g××100%=4g,氧元素的质量为36g﹣4g=32g,二氧化碳中的碳元素和水中的氢元素来自于该可燃物,该可燃物中氧元素的质量为32g+32g﹣64g=0,则该可燃物只含有碳、氢两种元素。故选B。 ...查看答案和解析>>
科目:初中化学 来源:山东省烟台龙口市2017-2018学年八年级下学期期中考试化学试卷 题型:单选题
关于氧气的叙述错误的是( )
A. 空气是无色无味的气体,空气中的氧气也是无色无味的气体
B. 氧气的液态和固态都是淡蓝色的
C. 氧气在通常状况下,不易溶于水,密度比空气略大
D. 在高山上出现高山反应是因为高山上没有氧气
D 【解析】氧气是一种无色无味的气体;氧气的密度比空气的密度大;氧气不易溶于水;液氧是淡蓝色的,固氧也是淡蓝色的。可以据此来分析并完成该题的解答。 【解析】 A、空气是无色无味的气体,空气中的氧气也是无色无味的气体,故A说法正确; B、氧气的液态和固态都是淡蓝色的,故B的说法正确; C、氧气在通常状况下,不易溶于水,密度比空气略大,故C说法正确; D、在高山上出现高...查看答案和解析>>
科目:初中化学 来源:山东省威海市文登区八校(五四学制)2017-2018学年八年级下学期期中考试化学试卷 题型:简答题
如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图,回答下列问题:

(1)图中①④所指过程的含义:
①__________________;④_____________________.
(2)在⑦所示的过程中臭氧层中的臭氧在日光的作用下转化成O2.臭氧是淡蓝色气体,臭氧层能有效阻挡紫外线,保护地球的生存环境.
①写出图示中臭氧转化为氧气的化学方程式_______________________
②请从组成和构成的角度,指出氧气和臭氧的相同点和不同点:_________________________.
(3)科学家的长期研究发现,大气中的二氧化碳浓度和气温变化有密切关系,请回答下列问题:
①科学家应用现代技术预测,如果大气中二氧化碳浓度为0.028%上升到0.056%,全球平均气温可能上升1.5℃到4℃,科学家作出此结论科学方法属于(_________)
A.推理 B假说 C. 类推 D.对比
②为减小大气中二氧化碳的浓度,我们应提倡使用的能源是(_________)
A、风能、煤、电能;B、太阳能、煤、潮汐能
C、石油、核能、草木燃料;D、太阳能、风能、水能等
(4)为解决温室效应加剧问题,科学家正在研究如下图所示的二氧化碳新的循环体系(部分生成物已略去)。从图中分析得出的下列结论中,正确的是(_____)

A.化合物甲可能含碳、氢、氧三种元素 B.I、II、Ⅲ中都消耗了二氧化碳
C.循环过程中不需要吸收能量 D.涉及的化学反应中元素的化合价不变
(5)日本科学家研制成功一种新型催化剂,在常压、300℃条件下,CO2和H2反应生成甲烷和水,该反应的化学方程式为_____________________.
工厂和汽车燃烧化石燃料生成二氧化碳 动物呼吸需要氧气 2O3 3O2 组成元素相同,分子构成不同 B D A CO2+4H2 CH4+2H2O 【解析】本题考查了自然界中的碳循环,二氧化碳的化学性质;二氧化碳对环境的影响,化学方程式的书写等。 (1)①表示工厂和汽车燃烧化石燃料生成二氧化碳;④表示动物呼吸需要氧气; (2)①臭氧能在日光的作用下反应生成氧气,化学方程式是2O3 3...查看答案和解析>>
科目:初中化学 来源:江苏省常州市2018届九年级下学期期中考试化学试卷 题型:实验题
实验室用如图所示装置制取并收集气体
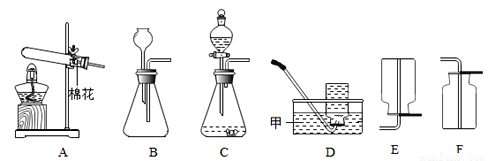
请回答下列各题
⑴ 仪器甲的名称________;
⑵用A装置制取氧气,则反应的化学方程式是___________;
⑶能直接用于实验室制取氢气的发生装置有________(填序号),能用于收集氢气的装置是_____________(填序号);
⑷下图为家庭制氧机内桶构造示意图,桶上设有制氧剂投药口和出气口。制氧时,在桶内Ⅰ、Ⅱ两室中装入一定量的水,而后从投药口中投入药品后,并立即将其关闭,从出气口即可呼吸氧气。
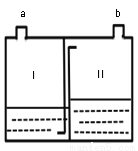
已知:i.制氧剂的主要成分是过碳酸钠和催化剂,过碳酸钠在水中能分解产生过氧化氢;
ii.产生的氧气需通入水中净化。
① 制氧机中过氧化氢发生反应的化学方程式为_________________;
② 氧气的出口为_________(填“a”或“b”)。
水槽 2KMnO4K2MnO4+MnO2+O2↑ C DE 2H2O22H2O+O2↑ a 【解析】⑴ 仪器甲的名称水槽;⑵用A装置制取氧气,属于固固加热型,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式是:2KMnO4K2MnO4+MnO2+O2↑;(3)实验室和用锌稀硫酸反应制取氢气,属于固液不加热型,故发生装置选C,B装置导管伸入过长,错误;氢气,难溶于水,可用排水...查看答案和解析>>
科目:初中化学 来源:山东省泰安市2018年九年级中考化学模拟试卷(二) 题型:计算题
实验室有一部分被氧化成氧化镁的镁粉样品、未知浓度盐酸和40%的氢氧化钠溶液。兴趣小组同学为分析样品中金属镁的质量百分含量和计算盐酸的质量分株,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量。实验数据如下表所示:
实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
Ⅰ | 16.0 | 60.0 | 0.5 |
Ⅱ | 16.0 | 130.0 | 1.0 |
Ⅲ | 16.0 | 150.0 | 1.0 |
镁粉样品中金属镁的质量百分含量为_________________。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数为_______________。(写出计算过程)
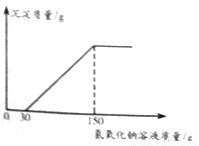
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com