
实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物,极易与空气中水蒸气和CO2反应而变质。同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究。
(1)【猜想】猜想Ⅰ:没有变质,“碱石灰”中只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和 Na2CO3
(2)【实验】如图所示:

|
|
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3溶于水无明显的温度变化,则猜想Ⅱ______________;
(填“成立”或“不成立”)
b.操作③发生反应的化学方程式为______________________________________;
由操作④的现象判断:滤液C中的溶质一定含有_______________(写化学式);
由此判断猜想Ⅰ_________(填“成立”或“不成立”)
c.综合a和b的结论,判断该样品变质情况为____________(填“全部变质”或“部分变质”) 下列对样品成分的分析正确的是______(填序号)。
① 样品中一定含NaOH ② 样品中一定含Na2CO3
③ 样品中含NaOH、CaO中的一种或两种
【拓展】由上述实验说明,实验室中“碱石灰”应_______保存;操作②中玻璃棒的作用是 ___________________。
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 实验操作 | 实验现象 | 实验结论及解释 |
| ① 取少量滤液C于试管中,加入足量CaCl2溶液 |
有白色沉淀生成 |
猜想③正确 |
| ② 过滤,在滤液中滴加无色酚酞试液 |
溶液由无色变成红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| [小资料] ①碱石灰是氧化钙、氢氧化钙的固体混合物.易吸收空气中的水蒸气和二氧化碳. ②氯化钙溶液显中性.[提出问题]实验室中久置的碱石灰样品的成分是什么? [进行猜想]久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分.用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 CaO+H2O═Ca(OH)2(或2NaOH+CO2═Na2CO3+H2O等,答案合理即可) CaO+H2O═Ca(OH)2(或2NaOH+CO2═Na2CO3+H2O等,答案合理即可) (写一个).[探究过程]  试回答下列问题: (1)操作①的名称是 过滤 过滤 ,溶液C中一定含OH- OH- 离子.(2)溶液A中加入CaCl2溶液后产生固体,说明样品中一定含有 碳酸钠 碳酸钠 ,反应的方程式为Na2CO3+CaCl2═2NaCl+CaCO3↓ Na2CO3+CaCl2═2NaCl+CaCO3↓ .(3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,说明CaCl2溶液已过量 取溶液C于试管中滴加碳酸钠溶液,有白色沉淀生成,说明CaCl2溶液已过量 .[实验结论] 依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 ②③ ②③ (填序号).①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种 [拓展延伸] 为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.请分析计算: (1)反应产生的CO2的质量为 4.4 4.4 g.(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程) 78.8%. 78.8%. .(3)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等.从钠元素质量守恒的角度解释其原因是: 氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸 氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸 .
查看答案和解析>> 科目:初中化学 来源: 题型:  碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究. 碱石灰是实验室常用的干燥剂.同学们为确认一瓶久置的“碱石灰”(可能已部分变质或全部变质)样品的成分,进行如下探究. 【提出问题】实验室中久置的碱石灰样品的成分是什么? 【进行猜想】 久置的碱石灰样品中可能含有CaO、NaOH、Na2CO3、Ca(OH)2、CaCO3等成分.用化学方程式表示样品中含有Ca(OH)2或Na2CO3可能含有的原因 【探究过程】 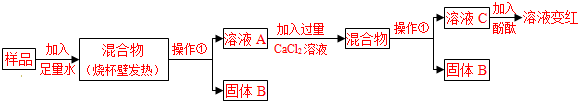 试回答下列问题: (1)操作①的名称是 (2)溶液A中加入CaCl2溶液后产生固体,该反应的方程式为 (3)向溶液A中加入CaCl2溶液后,证明CaCl2溶液过量的方法是 【实验结论】 依据上述实验操作过程及现象,综合对滤液和固体成分的探究,下列对样品成分的分析正确的是 ①样品中一定含NaOH ②样品中一定含Na2CO3 ③样品中含NaOH、CaO中的一种或两种 【拓展延伸】 (1)为测定实验室中一瓶变质的烧碱中NaOH的含量,某同学取50.0g烧碱样品,溶于一定量的水中得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.请分析计算样品中NaOH的质量分数是多少?(写出计算过程) (2)用同浓度的硫酸,分别与未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等.从钠元素质量守恒的角度解释其原因是: 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |