
| 温度/℃ | 室温 | 100 | 550 | 1400 |
| B装置/g | 200.00 | 201.80 | 205.04 | 205.04 |
| C中铜网/g | 100.00 | 100.00 | 100.00 | 101.28 |
分析 (一)根据材料的分类来分析;
根据合金的性质来分析;
(二)1、根据化学反应的原理以及化学方程式的写法来分析;
2、根据化合物中元素化合价的计算方法来分析;
(1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可;
铁矿石的选择原则:含铁量高,不含有害元素,冶炼过程中不产生或少产生污染环境的物质;
(2)根据反应的原理以及化学方程式的写法来分析;根据从混合物中分离纯净物的方法来分析;
(三)1、根据物质的性质以及检验方法来分析;
2、(1)根据实验操作的注意事项来分析;
(2)根据实验的要求与气体流通来分析;
(3)①根据题干信息与数据来分析计算;
②根据计算结果来分析解答.
解答 解:(一)(1)青铜是合金,属于金属材料;丝绸属于天然材料;陶瓷属于无机非金属材料;故填:C;
(2)铜的活动性弱,且深埋于地下隔绝了空气,所以青铜器不易生锈;故填:AC;
(二)1、碱式碳酸铜受热分解生成氧化铜、二氧化碳和水,反应的化学方程式为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑+2CuO;故填:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑+2CuO;
2、CuFeS2为二硫化亚铁铜,其中铜元素显+2价,铁元素显+2价,设硫元素的化合价为x,则(+2)+(+2)+2x=0,x=-2;故填:-2;
(1)工业上用CO和磁铁矿炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2.黄铁矿、黄铜矿含铁量低,含有对环境有害的元素硫,并且在冶炼过程中会产生有毒气体二氧化硫,污染环境,因此黄铁矿、黄铜矿不宜炼铁.故填:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;冶炼过程中会产生有毒气体二氧化硫,污染环境;
(2)①加入的铁粉能与硫酸铜反应生成铜和硫酸亚铁;故填:Fe+CuSO4=Cu+FeSO4;
②FeSO4溶液经蒸发浓缩、降温结晶、过滤等操作得到FeSO4•7H2O晶体.故填:降温结晶;
(三)1、可以向上层清液中滴加氢氧化钠溶液,若产生沉淀则氢氧化钠的量不足,若没有沉淀产生则氢氧化钠已经过量;故填:NaOH;
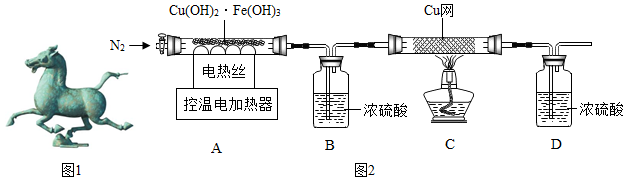
2、(1)对于有气体生成的反应,在实验前,一定要检查装置的气密性;故填:检查装置的气密性;
(2)为了使得生成水蒸气、氧气被完全吸收,所以停止加热后仍需继续通N2,故填:使生成的气体全部被B和C装置吸收;
(3)①设其中铜元素的质量为x.氢氧化铜受热会分解为氧化铜和水,方程式为Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,从室温加热到100℃时,装置B中增重的质量为氢氧化铜分解生成水的质量;由题干信息可知,经过一系列化学反应时,物质的关系是:
Cu~CuFeS2~CuSO4~Cu(OH)2~H2O
64 18
x (201.80-200.00)g
$\frac{64}{18}=\frac{x}{(201.80-200.00)g}$
x=6.4g
则此黄铜矿中铜元素的质量分数:ω(Cu)%=$\frac{6.4g}{25.00g}×100%=25.60%$;
设其中铁元素的质量为y.氢氧化铁受热会分解为氧化铁和水,方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,从100℃加热到550℃时,装置B中增重的质量为氢氧化铁分解生成水的质量;由题干信息可知,经过一系列化学反应时,物质的关系是:
2Fe~2CuFeS2~Fe2(SO4)3~Fe(OH)3~3H2O
112 54
y (205.04-201.80)g
$\frac{112}{54}=\frac{y}{(205.04-201.80)g}$
y=6.72g
则此黄铜矿中铁元素的质量分数:ω(Fe)%=$\frac{6.72g}{25.00g}×100%=26.88%$
故答案为:25.60%;26.88%;
②氧化铜受热分解的方程式为:4CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O+O2↑
设氧化铜分解生成氧气的质量为z,则
4Cu~4CuO~2Cu2O~O2
256 32
6.4g z
$\frac{256}{32}=\frac{6.4g}{z}$
z=0.8g
因为装置C增重的质量为氧化铜、氧化铁分解产生氧气的总质量,所以氧化铁分解生成氧气的质量为:(101.28g-100.00g-0.8g)=0.48g
氧化铁的质量为:6.72g÷$\frac{112}{160}×100%$=9.6g
生成的复杂铁的氧化物中含氧元素的质量为:9.6g-0.48g-6.72g=2.4g
复杂的铁的氧化物中铁原子与氧原子的个数比为:$\frac{6.72g}{56}$:$\frac{2.4g}{16}$=4:5
则复杂的铁的氧化物化学式为:Fe4O5;故填:Fe4O5.
点评 要理解炼铁的原理和方法过程,了解金属元素的存在及常见的金属矿物,注意炼铁过程中产生的副产物对环境的影响是解答这类题的关键.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
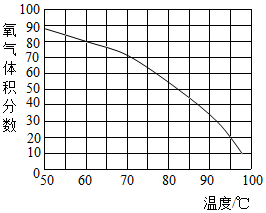 小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | l0 | 20 | 30 | 40 | 50 | 3l | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{盐酸}{→}$FeCl3 | B. | SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | ||
| C. | Na2CO3$\stackrel{Ca(NO_{3})_{2}}{→}$NaNO3$\stackrel{KCI}{→}$KNO3 | D. | CaCl2溶液$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{NaOH}{→}$Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 次数 | 实验前 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 0 | 50 | 50 |
| 剩余固体的质量/g | 5 | 3 | 2 |
| A. | 第 1 次加入稀盐酸后剩余固体中还有镁 | |
| B. | 第 2 次所加入的稀盐酸未反应完 | |
| C. | 每 50 g 稀盐酸和 1 g 镁恰好完全反应 | |
| D. | 合金样品中铜的质量分数为 40% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
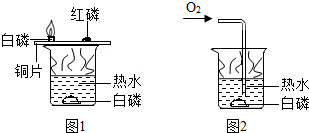
| A. | 铜片上的白磷燃烧,红磷不能燃烧,说明可燃物燃烧温度要达到着火点 | |
| B. | 铜片上的白磷燃烧,水中白磷不燃烧,说明可燃物燃烧要与氧气接触 | |
| C. | 水中白磷通过氧气前后的实验对比,说明可燃物燃烧要与氧气接触 | |
| D. | 只有图1实验,不能证明可燃物燃烧的两个条件,温度达到着火点和氧气接触 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 水是人类宝贵的自然资源.
水是人类宝贵的自然资源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com