
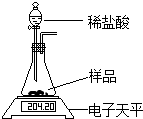
 某同学为了测定碳酸钠样品中Na2CO3的含量,取样品放在如下装置中,逐滴滴加稀盐酸(HCl)至不再有气泡冒出(假设产生的气体全部逸出).
某同学为了测定碳酸钠样品中Na2CO3的含量,取样品放在如下装置中,逐滴滴加稀盐酸(HCl)至不再有气泡冒出(假设产生的气体全部逸出).| 反应前/g | 反应后/g |
| 204.20 | 202.00 |
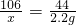


科目:初中化学 来源: 题型:阅读理解
 查阅资料可知:浓硫酸能吸水,且不与CO2反应:CO2能与NaOH溶液反应生成碳酸钠和水.某同学为了测定某石灰石矿样中碳酸钙的质量分数,按下列过程进行实验:用过量稀盐酸溶解矿样(杂质不与盐酸反应)→用浓硫酸干燥所得气体→用过量NaOH溶液吸收CO2→根据NaOH溶液的增重计算矿样中碳酸钙的质量分数,实验装置如下图所示:
查阅资料可知:浓硫酸能吸水,且不与CO2反应:CO2能与NaOH溶液反应生成碳酸钠和水.某同学为了测定某石灰石矿样中碳酸钙的质量分数,按下列过程进行实验:用过量稀盐酸溶解矿样(杂质不与盐酸反应)→用浓硫酸干燥所得气体→用过量NaOH溶液吸收CO2→根据NaOH溶液的增重计算矿样中碳酸钙的质量分数,实验装置如下图所示:查看答案和解析>>
科目:初中化学 来源: 题型:
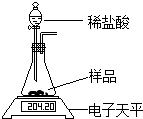 某同学为了测定碳酸钠样品中Na2CO3的含量,取样品放在如下装置中,逐滴滴加稀盐酸(HCl)至不再有气泡冒出(假设产生的气体全部逸出).
某同学为了测定碳酸钠样品中Na2CO3的含量,取样品放在如下装置中,逐滴滴加稀盐酸(HCl)至不再有气泡冒出(假设产生的气体全部逸出).| 反应前/g | 反应后/g |
| 204.20 | 202.00 |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省泰州市姜堰市溱潼二中九年级(上)开学考试化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省苏州市工业园区九年级(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com