将15.0g含杂质20%的硫铁矿(主要成分是含有硫、铁两种元素的化合物),高温煅烧(杂质不参加反应),充分反应后只得到二氧化硫气体和8.0g氧化铁固体.
(1)计算溶解8.0g氧化铁,需要10%的稀硫酸的质量.
(2)通过列式计算确定硫铁矿主要成分的化学式.
【答案】
分析:根据题干提供的数据结合反应的化学方程式进行计算即可.
解答:解:(1)设需要硫酸的质量为x
Fe
2O
3+3H
2SO
4═Fe
2(SO
4)
3+3H
2O
160 294
8.0g x
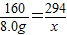
x=14.7g
需要10%的稀硫酸的质量为:14.7g÷10%=147g
(2)设硫和铁两种元素组成的化合物的化学式为Fe
xS
y,
15.0g含杂质20%的硫铁矿含Fe
xS
y的质量为:15.0g×(1-20%)=12.0g
化学反应前后元素的原子个数不变,根据铁原子个数守恒可得:
2Fe
xS
y ~xFe
2O
3
112+64y 160x
12.0g 8.0g

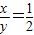
硫铁矿的主要成分是FeS
2
答:(1)需要10%的稀硫酸的质量为147g,
(2)硫铁矿主要成分的化学式为FeS
2.
点评:本题考查了根据化学方程式的计算,完成此题,可以依据反应的事实进行,书写反应的化学方程式要注意配平.




 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案