
| OH- | NO3- | SO42- | Cl- | |
| Ni2+ | 不 | 溶 | 溶 | 溶 |
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气体产生缓慢 金属逐渐溶解 | 气体产生激烈 金属迅速溶解 | 无明显现象 |
分析 实验活动一:根据两种白金中一种白金中含有锌,另一种白金是铂;在金属活动顺序表中锌在氢的前面,铂在氢的后面进行分析;
【作出假设】根据三种金属活动性中已知锌的活动性比铜强,加上镍后的顺序进行分析;
【记录现象】根据在金属活动顺序表中,铜位于氢的后面,所以铜和稀盐酸不反应进行分析;
【得出结论】根据判断金属的活动顺序可根据金属和稀酸反应的剧烈程度或产生气泡的快慢来判断进行分析;
【结论应用】(1)根据上面的结论:Zn>Ni>Cu可知镍的活泼性比铜强,故镍可以与硫酸铜溶液发生反应进行分析;
(2)根据比较三种金属的活动性强弱可以通过:“两金夹一盐”进行分析.
解答 解:实验活动一:由于两种白金中一种白金中含有锌,另一种白金是铂;在金属活动顺序表中锌在氢的前面,铂在氢的后面;所以取两种白金分别放入盛有稀盐酸的试管中,有气泡产生的是白色金,无气泡的是铂金;
【作出假设】由三种金属活动性中已知锌的活动性比铜强,加上镍后的顺序只能为①:Zn>Ni>Cu;②:Zn>Cu>Ni;③:Ni>Zn>Cu;
【记录现象】由于在金属活动顺序表中,铜位于氢的后面,所以铜和稀盐酸不反应,实验现象为:无明显现象;
【得出结论】判断金属的活动顺序可根据金属和稀酸反应的剧烈程度或产生气泡的快慢来判断;由记录现象可知Zn气体产生的最快,最活泼;Ni气体产生缓慢,次之;Cu不反应,最不活泼,所以原假设中正确的是:①,镍和盐酸反应生成氯化镍和氢气,化学方程式为:Ni+2HCl═NiCl2+H2↑;
【结论应用】(1)由上面的结论:Zn>Ni>Cu可知镍的活泼性比铜强,故镍可以与硫酸铜溶液发生反应;
(2)比较三种金属的活动性强弱可以通过:“两金夹一盐”,其含义是:用两头的金属放在中间的金属的盐溶液,通过现象得出三种金属的活动性顺序,所以设计所用的一组物质的化学式是:Zn、NiSO4溶液、Cu.
故答案为:(1)白色金,铂金;
(2)Ni>Zn>Cu;
【记录现象】无明显现象;
【得出结论】①,Ni+2HCl═NiCl2+H2↑;
【结论应用】①能;
②Zn、NiSO4溶液、Cu.
点评 做题时善于进行总结如:比较比较三种金属的活动性强弱可以通过:“两金夹一盐”的方法.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 空气是人类宝贵的自然资源.
空气是人类宝贵的自然资源.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
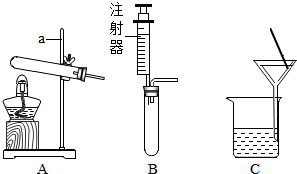 根据如图装置回答问题.
根据如图装置回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
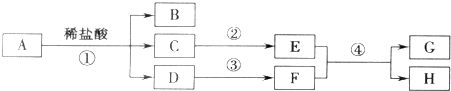
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com