

分析 根据A、B、C均为气体,A、B反应产生氨气,其中A、B为单质且A的相对分子质量为28,其中A为氮气,B为氢气,C为含有A组成元素的化合物,因此C为一氧化氮,然后根据信息完成相关的问题.
解答 解:(1)A、B、C均为气体,A、B反应产生氨气,其中A、B为单质且A的相对分子质量为28,其中A为氮气,B为氢气,C为含有A组成元素的化合物,因此C为一氧化氮;故填:N2;NO;
(2)氨与氧气反应生成一氧化氮和水,反应条件是高温、催化剂,故方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{高温}$4NO+6H2O;
(3)在化学反应中,只要有物质所含元素的化合价发生了变化的反应就是氧化还原反应,其中氮气和氢气的反应,氨气和氧气的反应,一氧化碳和氧气的反应都有单质的反应,因此元素的化合价一定变;二氧化氮和水反应产生一氧化氮和硝酸,氮元素的化合价也发生了改变,只有氨气和硝酸的反应没有元素化合价的改变,不属于氧化还原反应,因此属于氧化还原反应的有4个;故填:4.
点评 本题属于信息题的考查,考查了化学反应及化学肥料的知识,完成此题,可以依据已有的知识进行,能够考查学生运用知识的能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 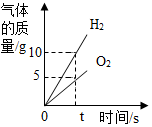 电解水 | |
| B. |  向两份完全相同的稀盐酸中分别加入锌粉和铁粉 | |
| C. | 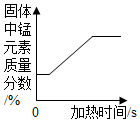 加热一定质量的高锰酸钾 | |
| D. | 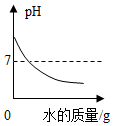 向一定量的氢氧化钠溶液中加水稀释 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | Ba(OH)2溶液 | C. | NaOH溶液 | D. | 盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
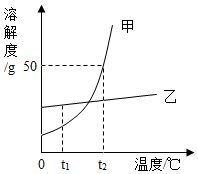 如图为甲和乙两种固体物质的溶解度曲线.回答下列问题:
如图为甲和乙两种固体物质的溶解度曲线.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 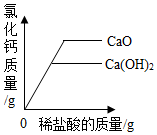 向等质量的氧化钙、氢氧化钙中分别加入等质量分数的稀盐酸至过量 | |
| B. | 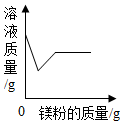 向一定质量氯化亚铁和氯化铝的混合溶液至加入镁粉至过量 | |
| C. |  向盐酸和氯化钙的混合溶液中逐滴加入纯碱溶液至过量 | |
| D. |  向等质量的镁、铝中分别加入等质量分数的稀硫酸至过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
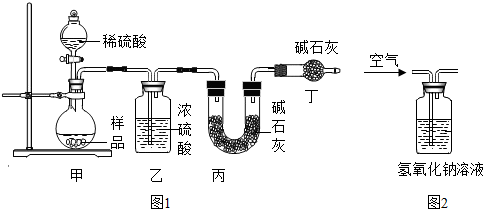

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com