
 某同学将维生素C泡腾片放入水中,观察到有大量气泡冒出,根据泡腾片主要成分分析,该气体主要是( )
某同学将维生素C泡腾片放入水中,观察到有大量气泡冒出,根据泡腾片主要成分分析,该气体主要是( )| A. | O2 | B. | N2 | C. | CO2 | D. | 水蒸气 |
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | 无气泡生成 | 猜想1正确 |
| 实验操作 | 实验现象 | 实验结论 |
| 1、取少量白色固体加入足量CaCl2溶液. | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2、过滤、取少量滤液加入 无色酚酞试液 | 试液变红 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
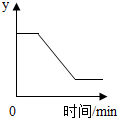 已知:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标表示的是( )
已知:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标表示的是( )| A. | 固体中氧元素的质量 | B. | 生成氧气的质量 | ||
| C. | 固体中二氧化锰的质量 | D. | 固体中钾元素的质量分数 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑥ | C. | ①③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 配制溶液时,只能用水作溶剂 | |
| B. | 配制硝酸铵溶液的过程中,溶液的温度会下降 | |
| C. | 用浓硫酸配制稀硫酸时,应将水缓缓注入浓硫酸中 | |
| D. | 将10g氯化钠溶于100g水中,得到质量分数为10%的氯化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料值得来黄铜(铜和锌的合金,外观似黄金),其生产流程如下:
我国古代将炉甘石(主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料值得来黄铜(铜和锌的合金,外观似黄金),其生产流程如下:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| NH3 | N2 | NO | NO2 | |
| 颜色 | 无色 | 无色 | 无色 | 红棕色 |
| 溶解性 | 极易溶于水 | 不溶于水 | 不溶于水 | 可溶于水或硝酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com