
【题目】中国环保部和国家标准委两个部门方便向WTO递交通知,宣布从2017年9月起,中国将禁止进口有关“洋垃圾”,力图减少环境污染,如电路板含有以下金属:Sn、Pb、Cu、Ag、Ni(镍,银白色)、Pd(钯,银白色),如果不回收,既是资源浪费,又会造成环境污染,如图是回收其中部分金属的流程图。(假设流程图中各反应均恰好完全反应,已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)写出红色固体A的名称_____。
(2)滤渣2中含有的金属是_____。
(3)步骤⑤反应的化学方程式_____。
(4)步骤⑥回收的纯净物B是_____(写化学式)。
(5)金属Ni的活动性比铁_____(填“强”或“弱”)。
(6)在①﹣⑥步操作过程中,使用次数最多的玻璃仪器是_____。
【答案】铜 Sn、Pb、Ni Fe+CuSO4=FeSO4+Cu FeSO4 弱 玻璃棒
【解析】
金属板加入足量的稀硫酸得到滤渣1和滤液1,滤渣1中加入稀硫酸、氧气控制温度加热,得到银、金、钯和滤液3,滤液3中加入铁粉会生成红色固体A,所以A是铜,滤渣1中含有银、金、钯、铜,滤液3是硫酸铜,滤液4是硫酸亚铁,所以铁、锡、铅、镍排在氢之前,滤液1中加铁得到硫酸亚铁和滤渣2,所以滤渣2中是锡、镍和铅;
(1)A是铜,故填:铜;
(2)滤渣2中含有的金属是:Sn、Pb、Ni;故填:Sn、Pb、Ni;
(3)步骤⑤是铁与硫酸铜反应生成硫酸亚铁和铜,故填:Fe+CuSO4=FeSO4+Cu;
(4)通过推导可知,步骤⑥回收的纯净物B是FeSO4;故填:FeSO4;
(5)金属Ni的活动性比铁要弱,故填:弱;
(6)在①﹣⑥步操作过程中,使用次数最多的玻璃仪器是玻璃棒,故填:玻璃棒。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳,而Na2CO3受热不分解.现有某工厂生产出的一批NaHCO3产品中混有少量的Na2CO3,某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案.
方案一:样品![]() 测定生成CO2的质量.
测定生成CO2的质量.

(1)本实验采用如图所示的装置,C中盛放的物质是 .
(2)若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下, (填“能”或“不能”)准确测定样品中NaHCO3的质量分数.
方案二:样品![]() 测定剩余固体质量.
测定剩余固体质量.
具体操作步骤如下:
①一只洁净的坩埚,称得质量为21.2克,再向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克.
(3)实验时需要重复“加热、冷却、称量”操作多次,其目的是 .
(4)根据题意,计算样品中NaHCO3的质量分数,写出计算过程.
(已知2NaHCO3![]() Na2CO3+H2O+CO2↑)
Na2CO3+H2O+CO2↑)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列事实的结论或解释中不正确的是( )
A. 水烧开后易把壶盖冲起﹣﹣说明温度升高分子会变大
B. 公园的桂花开放时满园飘香﹣﹣说明分子在不断运动
C. 酸碱中和反应都能生成水﹣﹣实质是H+与OH﹣ 结合生成了H2O
D. 浓盐酸在空气中生成白雾﹣﹣浓盐酸具有挥发性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一包白色粉末,可能由NH4Cl、Na2CO3、NaHCO3中的一种或几种组成。小莹为了探究其成分,进行了如下实验:
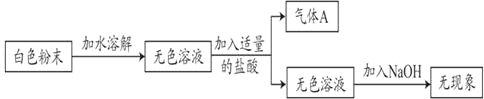
(1)由上述实验可知气体A是_____。
(2)根据上述的实验现象,原白色粉末一定没有_____。
(3)(发现问题)Na2CO3、NaHCO3与盐酸反应,均能产生气体,无法确定固体的成分。
(查阅资料)
①NaHCO3与可溶性的钙盐、钡盐混合没有沉淀产生。
②NaHCO3与足量的Ca(OH)2反应有白色沉淀产生。
(提出猜想)
猜想1:白色粉末只有_____;
猜想2:白色粉末只有Na2CO3;
猜想3:白色粉末是_____。
(实验探究)
小勇为了验证其猜想,取少量的白色粉末放入烧杯中,加水全部溶解后,加入足量的Ca(OH)2溶液,现象是_____,他就认为猜想二正确。小杰认为小勇的结论不正确,理由是_____,
于是他做了进一步的探究:
实验操作 | 现象 | 实验结论 |
取白色粉末于烧杯中,加水溶解,再加入BaCl2溶液充分搅拌,静置 | 若无_____现象 | 猜想_____成立 |
若_____ | 证明白色固体肯定有_____,可能有_____ | |
取10.6g白色粉末于锥形瓶中,加入足量稀盐酸后把生成的气体通入足量的NaOH溶液中,反应完全后称得NaOH溶液增重4.5g | 确认猜想_____成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. 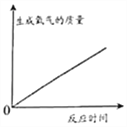 B.
B. 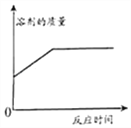
C. 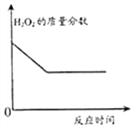 D.
D. 
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示的图象不能正确反映其对应变化关系的是( )
A.  一定质量的红磷在密闭容器中燃烧
一定质量的红磷在密闭容器中燃烧
B.  常温下向pH=10的某碱性溶液中加水稀释
常温下向pH=10的某碱性溶液中加水稀释
C.  向接近饱和的KNO3溶液中加入KNO3固体
向接近饱和的KNO3溶液中加入KNO3固体
D.  用等质量、等质量分数的过氧化氢溶液在有无催化剂条件下制氧气
用等质量、等质量分数的过氧化氢溶液在有无催化剂条件下制氧气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为A、B、C三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
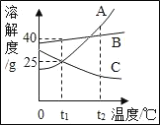
A. t1℃时,A、C两种物质饱和溶液中含有的溶质质量一定相同
B. t1℃时,A溶液溶质质量分数为20%
C. t2℃的三种物质的饱和溶液降温到t1℃时,溶质质量分数由大到小的顺序为B>A=C
D. t1℃时,125gA物质的饱和溶液加水稀释可以得到250g质量分数10%的A物质的溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。下面是对硫酸的性质、制取、用途等方面的探究,请你共同参与并回答有关问题。
(探究一)硫酸的性质
(1)探究浓硫酸的某些特性。
①用小木棍蘸取少量浓硫酸,放置一会后,可观察到___。
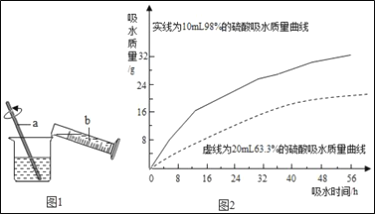
②浓硫酸的稀释:浓硫酸稀释过程如图1所示,b中盛放的物质是___,a的作用是___。
③兴趣小组把98%的浓硫酸10ml和63.3%的硫酸溶液约20mL分别放入两个相同的小烧杯中,称量、观察、记录、分析,根据室温环境下实验的数据绘成的曲线如图2.由图2曲线你能得到的实验结论:_____(写两点)。
(2)探究稀硫酸的化学性质。
如图3将适量的稀硫酸分别加入A~E的五只烧杯中。
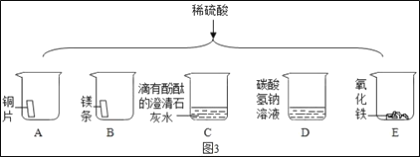
①有产生气泡的是___(填序号,下同);有白色沉淀生成的是___。
②能证明C中发生化学反应的现象是___。
(3)请写出稀硫酸的一种用途___。
(探究二)硫酸的工业制法。
工业上以黄铁矿为原料生产硫酸的工艺流程如图4所示。
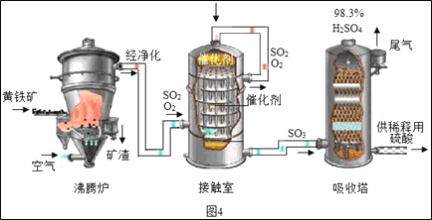
(1)接触室中发生的化学方程式为___。
(2)依据生产硫酸的工艺流程图,下列说法正确的是___(填字母序号)。
A 为使黄铁矿充分燃烧,需将其粉碎 B 催化剂能够提高SO2的反应速率和产量
C 吸收塔中得到的产品为混合物 D 沸腾炉排出的矿渣可供炼铁
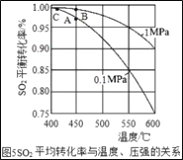
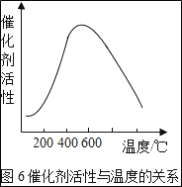
(3)接触室中的SO2平衡转化率与温度及压强的关系如图5所示。催化剂活性与温度的关系见图6.在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是___;___。
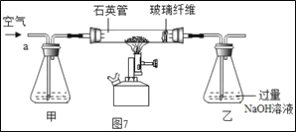
(探究三)探究某黄铁矿中FeS2的含量。
同学们进行了如下实验探究。
(查阅资料)①4FeS2 +11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3 +H2O2 =Na2SO4 +H2O
(实验探究)
Ⅰ称取1.60g黄铁矿样品放入如图7所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应。
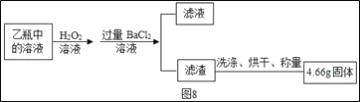
Ⅱ反应结束后,将乙瓶中的溶液进行如图8处理
(问题讨论)
(1)I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是___;II中滤液所含的溶质一定有___。
(含量测定)
(2)II中最终得到的4.66g固体是___(填化学式)。
(3)计算该黄铁矿中FeS2的质量分数为___。(写出计算过程)
(交流反思)
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会___(填“偏大”“偏小”“不变”)
(5)如何证明II中所加BaCl2溶液已过量(请简要写出操作方法及现象)___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海水中含有丰富的氯化镁,如图是从海水中提取镁的简单流程.在提取Mg的过程中,
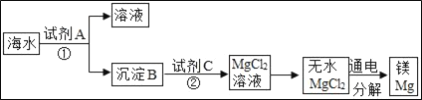
(1)试剂A最好选用_____(从我国有丰富的石灰石资源考虑).沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为_____;
(2)由无水MgCl2制取Mg的化学方程式为_____;
(3)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com