
| 10g-2g |
| 10g |
| 100 |
| 8g |
| 44 |
| x |


科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
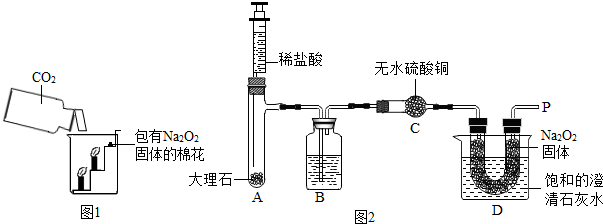
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、  。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
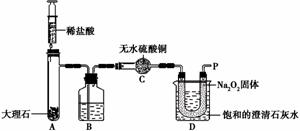
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
 | |||
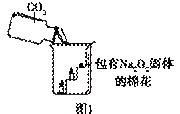 | |||
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放 置一根带火星的木条,观察现
置一根带火星的木条,观察现 象。
象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实 验结论】
验结论】 ①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式  。
。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。
查看答案和解析>>
科目:初中化学 来源:2012年江苏省无锡市滨湖中学中考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,![]() 同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳
具有 的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需
满足 、 ![]() 。
。
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。
2.无水硫酸铜为白色固体,吸水后变为蓝色。
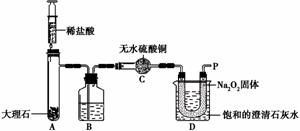 【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
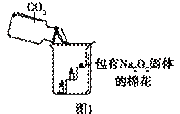 |
【实验步骤】①检查整套装置的气密性; ②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象。
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊。
【实验分析】①B装置内盛放的试剂是 ;②D装置烧杯内澄清石灰水变浑浊的原因可能是 ![]() ,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊。
【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是 。
②写出Na2O2和CO2反应的化学方程式 。
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com