
石英的主要成分为二氧化硅,其化学式为SiO2。它是玻璃工业和陶瓷工业的原料,冶金工业的助熔剂。
(1)二氧化硅属于 (填“酸”、“碱”、“盐”、“氧化物”或“有机物”中一种)。
(2)装有氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,Na2SiO3使瓶口与瓶塞粘合在一起,该反应的化学方程式为 。
(3)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:
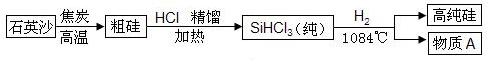
①制备粗硅的反应为:SiO2+2C Si +2CO↑,反应的类型是 反应(填“分解”“化合”“置换”“复分解”之一)。
Si +2CO↑,反应的类型是 反应(填“分解”“化合”“置换”“复分解”之一)。
②整个制备过程必须达到无水无氧,若在H2还原SiHCl3过程中混入O2,可能引起的后果是 。
③物质A通常状况下为无色有刺激性气味的气体,排放到空气中会引起环境污染,下列试剂可以吸收A的是: (填字母序号)。
A.浓硫酸 B.氢氧化钠溶液 C.金属铁 D.氯化钠溶液
氧化物 2NaOH+SiO2=Na2SiO3+H2O 置换 发生危险,引起爆炸 B
【解析】
试题分析:(1)二氧化硅是由硅元素和氧元素两种组成的纯净物,故属于氧化物。
(2)根据题意可知,该反应的反应物是NaOH和SiO2,生成物是Na2SiO3和H2O,条件是常温,故反应的化学方程式为2NaOH+SiO2=Na2SiO3+H2O。
(3)①根据反应的化学方程式可知,该反应的反应物和生成物都是一种单质和一种化合物,故属于置换反应;
②由于氢气是可燃性气体,若不纯,遇热可能发生爆炸,故整个制备过程必须达到无水无氧,若在H2还原SiHCl3过程中混入O2,可能引起的后果是硅被氧化得不到高纯硅,且发生爆炸;
③由生产高纯硅的流程示意图,结合质量守恒定律可知,物质 A中应含有H、Cl元素,再根据“物质A通常状况下为无色有刺激性气味的气体”,可知A的化学式是HCl,故可用氢氧化钠溶液来吸收。故选B
考点:物质的相互转化和制备,常见的氧化物、酸、碱和盐的判别,反应类型的判定,书写化学方程式
点评:本题难度不大,但涉及的知识点较多,掌握氧化物的概念、反应类型的判定方法,理解和掌握质量守恒定律的内容及其应用,是解题的关键。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com