
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
 |  |  |
| 实验一 | 实验二 | 分析 |
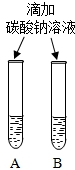 | 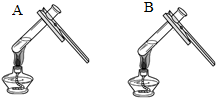 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

分析 (1)根据氢氧化钠的化学性质进行分析;
(2)根据二氧化碳与氢氧化钠、氢氧化钙、水的反应;
(3)根据氢氧化钠与氢氧化钙的溶解性进行分析;
(4)【提出猜想】根据氢氧化钠的制法和变质进行分析;
【反思评价】②根据氢氧根离子验证进行分析;
(5)①分析反应可发现,反应前为碳酸钠和氯化钠的混合物,而反应后得到固体为氯化钠,质量增加了12.1g-11g=1.1g,而该过程中是固体的质量增加了,所以可以根据差量法进行解答;
②反应后溶液的质量为反应前样品的质量+稀盐酸的质量-生成的二氧化碳的质量,然后结合溶液中溶质的质量分数的计算公式进行计算即可.
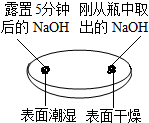
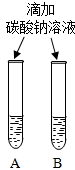
解答 解:(1)由上图实验一、二可知,氢氧化钠会吸收空气的 H2O、CO2,因此要密封保存;
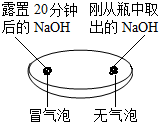
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,A瓶内发生反应为二氧化碳与氢氧化钠溶液反应,对比A瓶与C瓶的实验现象可证明CO2能与NaOH发生反应;
(3)考虑氢氧化钠与氢氧化钙的溶解性:两种方案中均观察到A试管内出现白色浑浊,A中试剂为饱和氢氧化钙溶液;方案二的设计原理是利用了氢氧化钙的溶解度随温度升高而减少;氢氧化钠的溶解度随温度升高而升高;两者的溶解度受温度影响情况不同;
| 实验一 | 实验二 | 分析 |
 | 微热(不考虑水分蒸发)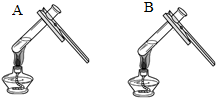 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大 |
| 实验一 | 实验二 | 分析 |
| 饱和氢氧化钙溶液;氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大 |
点评 熟练掌握二氧化碳和氢氧化钠、氢氧化钙的化学性质,能够根据物质的性质设计实验对物质进行鉴别,在学习中要注意培养自己设计实验的能力.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:初中化学 来源: 题型:选择题
| A. | 用甲醛溶液浸泡海产品保鲜 | |
| B. | 有机物都是含碳的化合物,CO、CO2也是有机物 | |
| C. | 化学纤维和羊毛可以用燃烧法区别 | |
| D. | 生物微量元素是人体必需的营养素,多吃无害 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气中氧气的体积分数约为21% | |
| B. | 惰性气体一般不跟其他物质发生反应 | |
| C. | 二氧化碳含量上升不会影响环境 | |
| D. | 敞口放置的饼干变软与水蒸气有关 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盐:④⑨ | B. | 酸:②④ | C. | 氧化物:③⑤ | D. | 混合物:①⑥⑦⑧ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2个氮原子:2N | |
| B. | 三氧化二铝中铝元素的化合价:${\;}_{A{l}_{2}{O}_{3}}^{+3}$ | |
| C. | 2个钠离子:2Na- | |
| D. | 一个水分子:H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
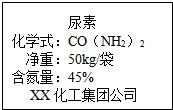 尿素是一种农业上常用的高效氮肥,它的化学式为CO(NH2)2.
尿素是一种农业上常用的高效氮肥,它的化学式为CO(NH2)2.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 80% | B. | 56% | C. | 20% | D. | 70% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com