
分析 (1)根据氢氧化钠的质量利用化学反应方程式可求出生成氯化钠的质量以及稀盐酸中溶质的质量进行解答;
(2)利用溶质的质量分数=$\frac{溶质质量}{溶液质量}$×100%进行解答.
解答 解:(1)设可生成氯化钠的质量为x,稀盐酸中溶质的质量为y.
HCl+NaOH═NaCl+H2O
36.5 40 58.5
y 100g×40% x
$\frac{36.4}{y}=\frac{40}{100g×40%}=\frac{58.5}{x}$
x=58.5g
y=36.5g
(2)稀盐酸中溶质的质量分数=$\frac{36.5g}{100g}×100%$=36.5%
答:(2)生成氯化钠的质量为58.5g;(3)稀盐酸中溶质的质量分数为36.5%.
点评 本题主要考查了根据化学方程式进行的有关计算,解答时、理清各物质的关系正确的书写化学方程式,找准质量关系并列比例式求算即可.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
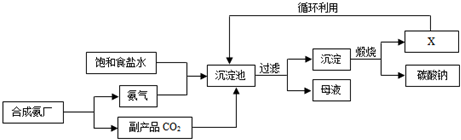
| A. | 沉淀池中的反应物只有两种 | |
| B. | 物质X是氨气,它可以循环使用 | |
| C. | 沉淀为碳酸钙 | |
| D. | 通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
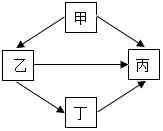 甲、乙、丙、丁为初中化学常见物质,他们之间有如图所示的反应关系(“→”表示一种物质能转化成另一种物质,部分反应物和生成物及反应条件已略去).回答下列问题:
甲、乙、丙、丁为初中化学常见物质,他们之间有如图所示的反应关系(“→”表示一种物质能转化成另一种物质,部分反应物和生成物及反应条件已略去).回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
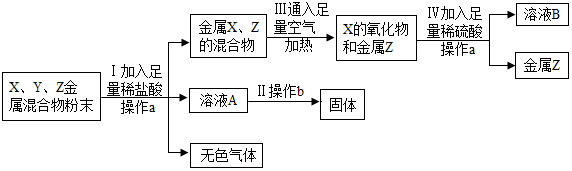
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
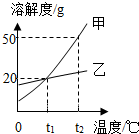 甲、乙两种物质的溶解度曲线如图所示,下列说法错误的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法错误的是( )| A. | t1℃时,甲和乙的溶解度相等 | |
| B. | t1℃时,20g乙加到100g水中形成饱和溶液 | |
| C. | t2℃时,甲乙各100g饱和溶液降温到t1℃析出的晶体甲比乙多30g | |
| D. | 若家中含有少量乙,提纯甲可用冷却热饱和溶液的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com