
| A. | NaOH | B. | MgCl2 | C. | Na2CO3 | D. | CaO |
分析 A、氢氧化钠溶液显碱性.
B、氯化镁能和氢氧化钙反应生成氢氧化镁沉淀和氯化钙;
C、氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠;
D、氧化钙能和水反应生成氢氧化钙.
解答 解:A、氢氧化钠溶液显碱性,溶于水后溶液pH会有变化,故选项错误;
B、氯化镁能够消耗石灰水中的氢氧化钙,从而使氢氧化钙的质量分数变小,溶液的pH减小.故选项错误;
C、氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠.从而使溶液的pH发生变化.故选项错误;
D、氧化钙能和水反应生成氢氧化钙,冷却至室温后石灰水仍然是饱和溶液,氢氧化钙的质量分数不变,溶液的pH不变.故选项正确.
故选D.
点评 解答本题要从各种物质能否与氢氧化钙反应的方面进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
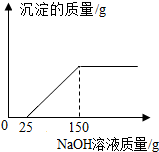
| 反应时间 | t0 | t1 | t2 | t3 | t4 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 同学 | 溶液中检验出的物质 |
| 小明 | Na2SO4,Na2CO3 |
| 小红 | Na2SO4,BaCl2,Na2CO3 |
| 小军 | Na2SO4,NaCl,Na2CO3 |
| A. | 由于BaCl2和Na2SO4、Na2CO3均不共存,所以小红的结论一定是不正确的 | |
| B. | 小明在溶液中加入了足量的稀硝酸,其目的是检验CO32-的存在并将其除去 | |
| C. | 小明接下来在溶液中加入了足量的Ba(NO3)2溶液,用来检验是否存在SO42-,并将产生的沉淀完全过滤 | |
| D. | 小军同学在被测溶液中加入了足量的BaCl2溶液,过滤后在滤液中加入硝酸银溶液后发现有白色沉淀,说明原溶液中含Cl-,则小明的结论也是错误的 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
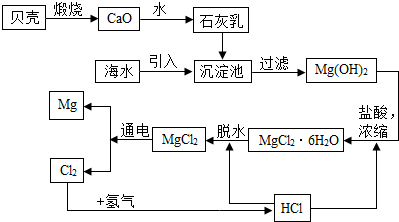
 现有16g Fe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100克足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题:
现有16g Fe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100克足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 固体样品可能是由Cu和Cu2O组成 | |
| B. | 固体样品可能是由CuO和Cu2O组成 | |
| C. | 固体样品可能是Cu和CuO | |
| D. | 固体样品可能是由Cu、CuO和Cu2O组成 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com