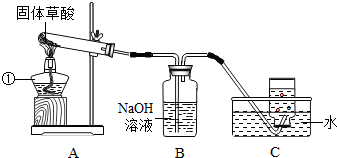
(2010?黄石)某化学活动小组的同学在探究金属与酸反应时,发现铜与浓硫酸在加热条件下能够发生反应,并产生大量气体.
[提出问题]产生气体的成分是什么呢?
[分析讨论]经分析讨论,大家认为产生的气体可能是H
2、SO
2、SO
3、O
2等气体,经进一步查验后确认没有SO
3、O
2,于是大家决定进一步探究气体成分.
[提出猜想]猜想①:产生的气体仅为SO
2;猜想②:产生的气体仅为H
2;你认为猜想③
产生的气体为SO2和H2的混合气
产生的气体为SO2和H2的混合气
.
[查阅资料]SO
2是一种有毒气体,不能燃烧,能使红色的品红溶液变为无色,是一种主要大气污染物.H
2则不能使红色品红溶液褪色.铜与浓硫酸反应时,硫酸总会剰余.
[设计实验]该小组的同学据此设计并完成了如图所示的实验
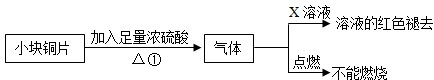
[分析与结论]
(1)图中X为
品红
品红
溶液.
(2)由以上实验可知:猜想
①
①
(填①、②、③)正确.
[反思与评价]
(3)与活泼金属和稀硫酸的反应不同,铜与浓硫酸反应时,硫元素的化合价
降低
降低
.
(4)实验结束后,有同学认为在处理图中反应①试管中残液时,应先用水将残液稀释,正确的操作方法是
将残液慢慢地加入水中,并不断搅拌
将残液慢慢地加入水中,并不断搅拌
.
(5)另有同学认为多余的气体应通入一个装有NaOH溶液的烧杯中,其原因是
吸收多余的SO2
吸收多余的SO2
.




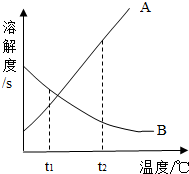 (2010?黄石)已知A、B两种固体的溶解度曲线如图所示,试回答下列问题:
(2010?黄石)已知A、B两种固体的溶解度曲线如图所示,试回答下列问题: