
分析 (1)根据浓盐酸具有挥发性进行解答;
(2)由生成二氧化碳气体的质量,根据反应的化学方程式计算出石灰石中碳酸钙的质量,进而可计算出石灰石中碳酸钙的质量分数.
解答 解:(1)浓盐酸具有挥发性,挥发出的氯化氢气体混入二氧化碳中,使制得的气体不纯;
(2)设样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
解得:x=10g
该样品中碳酸钙的纯度为:$\frac{10g}{12g}$×100%=83.3%
答:该样品中碳酸钙的纯度为83.3%.
故答案为:(1)浓盐酸具有挥发性,挥发出的氯化氢气体混入二氧化碳中,使制得的气体不纯;
(2)83.3%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.


科目:初中化学 来源: 题型:选择题
| A. | 蜡烛在空气中燃烧生成二氧化碳和水 | |
| B. | 红磷在空气中燃烧产生大量的白烟 | |
| C. | 木炭在氧气中燃烧更旺,并发出白光 | |
| D. | 铁丝在氧气中剧烈燃烧,火星四射 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体,倒入适量水,充分搅拌、静置 | 无放热现象 | 固体中一定不含CaO |
| ②取上层清液于试管中,通入二氧化碳 | 变浑浊 | 固体中一定含Ca(OH)2 |
| ③另取少量固体放入试管中,加入稀盐酸 | 有气泡冒出 | 固体中一定含CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素和三氧化二砷都属于氧化物 | |
| B. | 青蒿素和三氧化二砷都是由分子构成 | |
| C. | 碳、氢、氧原子保持青蒿素的化学性质 | |
| D. | 三氧化二砷中含有臭氧(O3)分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
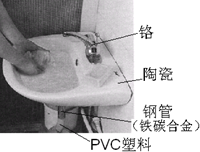 如图是家庭自来水池图片,请回答下列问题:
如图是家庭自来水池图片,请回答下列问题: .
.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧产生大量白雾 | |
| B. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 电解水实验中,正极产生的气体体积是负极的2倍 | |
| D. | 碳在空气中燃烧生成二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
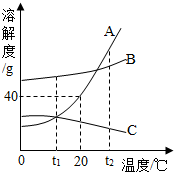 如图为A、B、C三种物质的溶解度曲线,据图回答:
如图为A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com