
【题目】在生活生产中,铁的应用非常广泛。
(一)认识铁元素及含铁物质
(1)人体缺铁会导致_____(选填序号)。
A 佝偻病 B 贫血症 C 甲状腺疾病
(2)铁与铬(Cr)、镍(Ni)等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料。以上叙述中不涉及到_____(选填序号)。
A 合金 B 无机非金属材料 C 合成材料 D 复合材料
(3)冬季取暖人们常用到暖宝宝,其热量来源于铁的缓慢氧化。已知暖宝宝的主要成分为铁粉、炭粉和少量氯化钠,暖宝宝反应的主要原理是铁粉与氧气、水共同作用生成氢氧化铁,写出反应的化学方程式:_____;氯化钠的作用是_____。
(二)制备硫酸亚铁铵晶体的探究
硫酸亚铁铵晶体((NH4)aFeb(SO4)c·xH2O)(俗称摩尔盐晶体)是一种重要的化工原料,用途十分广泛。某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成的流程如下:
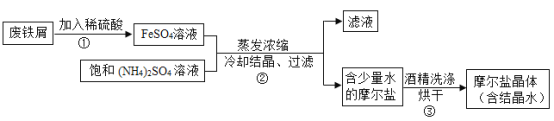
资料:硫酸亚铁铵晶体易溶于水,不溶于乙醇;
(4)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍,碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH_____7(填“>”、“=”、“<”)
(5)操作③中使用乙醇汽油洗涤可以快速晾干。这样做的优点是_____;
A 避免用水洗涤所造成的晶体损耗
B 酒精易挥发,可低温晾干晶体
C 防止硫酸亚铁被氧化
(三)硫酸亚铁铵晶体分解的定性探究
硫酸亚铁铵晶体受热分解可得到氧化铁。兴趣小组在科研人员指导下设计实验探究硫酸亚铁铵晶体受热分解的产物。
(6)甲组同学设计了如图1所示实验装置:
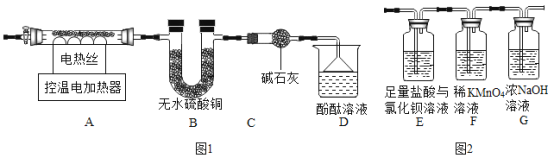
①实验中,装置B中观察到的现象是_____;
②装置D中观察到酚酞溶液变红色,由此可知分解的产物中有_____(写化学式)。
(7)乙组同学认为硫酸亚铁铵晶体受热分解的产物中还有SO2、SO3。为进行验证,用甲组实验中的装置A和上图2所示装置连接进行实验。观察到装置E中有白色沉淀生成,证明了有SO3生成,写出该反应的化学方程式_____;而F装置中_____、表明生成了SO2。
(四)硫酸亚铁铵晶体成分的定量探究
(实验步骤):取3份质量均为7.84g的(NH4)aFeb(SO4)c·xH2O晶体,分别进行实验。①向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3②向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀③加热第三份晶体使其分解,剩余固体质量与温度的关系如图所示
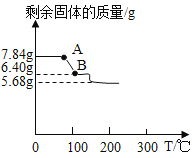
回答下列问题:
资料:硫酸亚铁铵晶体受热时,在200℃以下只失去结晶水。
(8)实验中加入过量BaCl2溶液的目的_____;
(9)根据实验数据,计算硫酸亚铁铵晶体的化学式_____;写出A点到B点发生反应的化学方程式_____。
【答案】B B 4Fe+6H2O+3O2=4Fe(OH)3 加速铁粉的锈蚀 > AB 白色固体变成蓝色 NH3 H2SO4+BaCl2═BaSO4↓+2HCl 紫色溶液变成无色 将硫酸根离子全部沉淀 FeSO4(NH4)2SO46H2O(或(NH4)2Fe(SO4)26H2O) FeSO4(NH4)2SO46H2O ![]() FeSO4+(NH4)2SO42H2O+4H2O。
FeSO4+(NH4)2SO42H2O+4H2O。
【解析】
(1)铁是合成血红蛋白的主要元素,缺乏会患缺铁性贫血;
(2)不锈钢丝属于合金,聚乙烯纤维属于合成材料,耐酸防护服材料属于复合材料;故选B。
(3)根据描述可知该反应的反应物是铁粉与氧气、水,生成物是氢氧化铁,反应的化学方程式表示为:4Fe+6H2O+3O2=4Fe(OH)3;氯化钠能加速铁粉生锈,更快地放出热量;
(4)碳酸钠溶液可除去油渍是因为碳酸钠溶液显碱性,pH>7;
(5)硫酸亚铁溶于水不溶于酒精,用A方法洗涤硫酸亚铁晶体损失较多,可用酒精洗涤,酒精易挥发,能得到大量的纯净的硫酸亚铁晶体;故选AB。
(6)硫酸亚铁铵晶体受热时会失去结晶水,白色的无水硫酸铜遇水会生成蓝色的硫酸铜晶体;装置D中观察到酚酞溶液变红色,说明硫酸亚铁铵晶体受热时会分解生成碱性气体,根据质量守恒定律该气体应该是NH3;
(7)装置E中有白色沉淀生成,证明了有SO3生成,说明SO3与水反应生成了硫酸,硫酸与氯化钡反应生成白色的硫酸钡沉淀,反应的化学方程式为:H2SO4+BaCl2═BaSO4↓+2HCl;二氧化硫具有漂白性,可使紫色高锰酸钾溶液褪色;
(8)氯化钡和硫酸亚铁反应生成硫酸钡沉淀和氯化铁,氯化钡过量就是为了将硫酸根离子全部沉淀;
(9)由工艺流程图知,硫酸亚铁铵晶体可看做是硫酸亚铁、硫酸铵和结晶水按一定比例形成,设该物质的化学式为xFeSO4y(NH4)2SO4zH2O,则
设硫酸亚铁铵晶体中硫酸铵的质量为x;
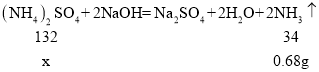
![]() x=2.64g
x=2.64g
设和硫酸铵反应生成硫酸钡沉淀的质量为y

![]() y=4.66g
y=4.66g
所以和硫酸亚铁反应产生硫酸钡沉淀的质量为9.32g-4.66g=4.66g;
设和硫酸亚铁反应生成硫酸钡沉淀的质量为z
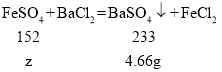
![]() z=3.04g
z=3.04g
所以硫酸亚铁铵中:![]()
![]()
由A→B固体质量减轻的质量就是生成的水的质量,7.84g硫酸亚铁铵晶体中水的质量为7.84g-5.68g=2.16g,![]() ,所以
,所以![]() ,所以x:y:z=1:1:6,故硫酸亚铁铵的化学式为FeSO4(NH4)2SO46H2O(或(NH4)2Fe(SO4)26H2O),加热FeSO4(NH4)2SO46H2O分解得到硫酸亚铁、硫酸铵、和水,化学反应方程式为:FeSO4(NH4)2SO46H2O
,所以x:y:z=1:1:6,故硫酸亚铁铵的化学式为FeSO4(NH4)2SO46H2O(或(NH4)2Fe(SO4)26H2O),加热FeSO4(NH4)2SO46H2O分解得到硫酸亚铁、硫酸铵、和水,化学反应方程式为:FeSO4(NH4)2SO46H2O ![]() FeSO4+(NH4)2SO42H2O+4H2O。
FeSO4+(NH4)2SO42H2O+4H2O。


科目:初中化学 来源: 题型:
【题目】在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水实验的装置图,回答下列问题:
(1)通电一段时间后电极上出现的现象是__________,用带火星的木条检验a管内的气体的现象是__________;b管内生成的气体的化学式为 _________。
(2)根据图2该反应中发生分解的微粒名称是_________,不变的微粒名称是____。
(3)写出电解水的文字表达式___________。
(4)该实验证明了水是由__________ 组成的。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】不少同学都被蚊虫叮咬过,感觉又痛又痒。同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内分泌出蚁酸刺激皮肤。课外兴趣小组同学决定对蚁酸进行探究。
(提出问题)蚁酸的成分是什么?它有什么性质?
(查阅资料)蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;蚁酸在一定条件下会分解生成两种氧化物。
(实验探究一)探究蚁酸的酸性。
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成红色,说明蚁酸溶液显_____;
(2)将锌粒放入盛有蚁酸溶液的试管中,有气泡产生,该气体是________。
(实验探究二)探究蚁酸分解的两种产物。
(1)小芳同学根据蚁酸中含有____________元素,推测出生成物中含有水;
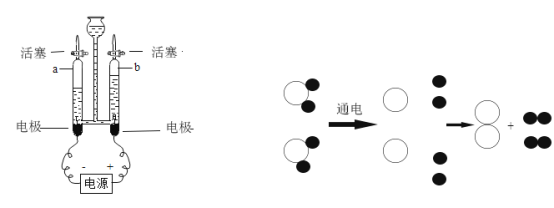
(2)另一种生成物是气体,小敏提出两种猜想: 猜想①:该气体是CO2 ;猜想②:该气体是____;他们将蚁酸分解产生的气体通过如图装置(铁架台已略去),观察现象。
Ⅰ.实验时装置A中无明显变化,则猜想①__________(填“成立”或“不成立”);
Ⅱ.装置B中的现象是_________,装置C中发生反应的化学方程式为___________________。
(讨论交流)从环保角度看,该装置的缺陷是____________,处理的方法是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
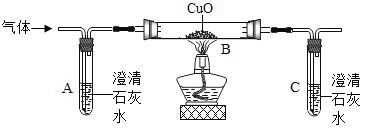
【题目】下图为实验室常用的实验装置。回答下列问题:
(1)写出装置图中标号仪器的名称:a________;b________。
(2)A、F组合制氧气,氧气收集完毕,应先________(填“熄灭酒精灯”或“从水中取出导气管”)。
(3)写出一个用B、E组合制取气体的化学反应方程式为_______________。
(4)硫化氢气体(H2S)有毒,溶于水形成酸。用块状硫化亚铁(FeS)和稀硫酸发生复分解反应制得H2S,反应的化学方程式为________。某同学用下图G、H、I组合收集H2S。
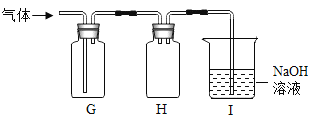
用G收集H2S,说明其密度比空气________(填“大”或“小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】FeCl3溶液腐蚀铜、铁的反应分别为:Cu+2FeCl3=2FeCl2+CuCl2、Fe+2FeCl3=3FeCl2。从腐蚀过镀铜器件的废液中回收铜,并重新制得FeCl3的流程如下:
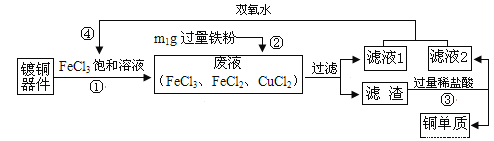
下列说法不正确的是( )
A.步骤②中发生化合反应与置换反应
B.“滤液1”中一定含FeCl2,可能含CuCl2,滤渣中一定含有铜可能含有铁
C.步骤④反应为:2M+2FeCl2+ H2O2=2FeCl3+2H2O,M是HCl
D.若滤渣也为m1g,则废液中FeCl3与CuCl2的质量比为65∶27
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室常用的制取气体的装置,根据所学知识回答下列问题:
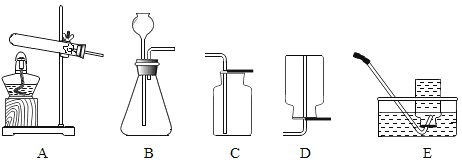
(1) 实验室用高锰酸钾制取氧气的化学方程式是____,所选用的发生装置是______(填序号),用C装置收集氧气时,验满的方法是____。
(2) 小丽欲使用下图装置收集较纯净的氧气,则应先将装置中装满水,再将气体从_____(填“a”或“b”)端通入。

(3) 小丽用排新制的澄清石灰水的方法收集了半瓶氧气,然后将燃着的木炭伸入该集气瓶中继续做气体性质实验,能观察到的现象有________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某干燥剂含有CaO、NaOH和CaCl2中的两种物质。为了探究其成分,设计了如图所示实验。下列说法正确的是( )
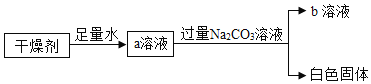
A.溶液a形成过程中一定只发生物理变化B.b溶液中一定有NaOH和Na2CO3
C.得到的白色固体一定不是纯净物D.干燥剂一定由 NaOH和CaCl2组成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学小组为探究铝、铜、银三种金属的活动性顺序,设计了下图所示实验方案(金属 丝使用时均已用砂纸打磨)。下列说法正确的是()
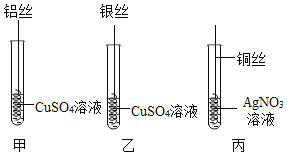
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Ag>Cu
C.实验甲中的CuSO4改为CuCl2,也能完成本实验探究
D.若要探究铝、铜、银活动性顺序,甲、乙、丙实验必须全做
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验时,有同学不小心放错了胶头滴管,使得NaNO3溶液的试剂瓶中可能混入NaCl、NaOH、Na2CO3和 Na2SO4中的一种或几种。为了验证,他进行了如图所示的实验。
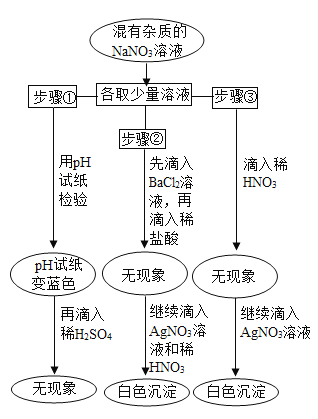
请回答:
(1)由步骤①得知,此溶液中含有(写化学式,下同)_____。
(2)由步骤②得知,此溶液中不存在_____。
(3)由步骤③得知,此溶液中含有_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com