
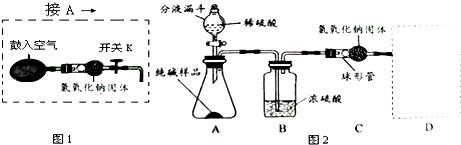
分析 (1)根据反应方程式的写法和反应的实验现象判断是否反应完全;(2)根据浓硫酸的吸水性和方程式的写法考虑;(3)根据D装置的作用考虑;(4)根据反应结束后装置内残留二氧化碳考虑;(5)①根据图1的用途考虑;②根据气体将反应生成的二氧化碳赶到C装置考虑;③根据图1 中氢氧化钠可以吸收二氧化碳考虑;(6)根据C装置质量的增加量就是生成二氧化碳的质量,根据二氧化碳的质量算出碳酸钠的质量,再除以样品的质量乘以百分之百即可;(7)根据盐酸的挥发性考虑;(8)根据改进后装置的优点考虑.
解答 解:(1)反应物是Na2CO3和H2SO4生成物是Na2SO4、H2O和CO2用观察法配平,二氧化碳后面标上上升符号;因为该反应有气泡产生,没有气泡产生了,说明反应完了;
(2)浓硫酸具有吸水性,所以主要是除去二氧化碳中的水蒸气;C装置中反应的反应物是NaOH和CO2生成物是Na2CO3和H20,用观察法配平;
(3)D装置是防止空气中的水、二氧化碳进入C装置造成误差,所以用装氢氧化钠固体的球形管就能达到目的;
(4)反应结束后在AB装置中会残留反应生成的二氧化碳气体未被C中的氢氧化钠吸收,导致二氧化碳质量减少,结果会偏小;
(5)①鼓入的空气经过了氢氧化钠,已经把空气中二氧化碳除去,用不含二氧化碳的空气排出AB装置中原有的空气,由于原有的空气中含有二氧化碳;
②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体,使反应产生的二氧化碳全部被C装置吸收;
(6)C装置质量的增加量就是生成二氧化碳的质量,所以生成二氧化碳的质量为:79.6g-75.2g=4.4g,设要生成4.4g二氧化碳需要碳酸钠质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 4.4g
根据:$\frac{106}{44}$=$\frac{44}{4.4g}$
解得X=10.6g,纯碱的纯度为$\frac{10.6g}{10.8g}$×100%=98.1%;
(7)稀盐酸挥发出氯化氢气体,被C装置吸收,影响实验测定;
(8)改进后装置的优点有:反应生成的CO2尽可能被C装置吸收;避免AB装置中原来空气中二氧化碳气体对实验的干扰.
故答案为:(1)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;逐滴滴入稀硫酸至不再产生气泡为止;
(2)除去水蒸气;2NaOH+CO2═Na2CO3+H20;(3)装氢氧化钠固体的球形管;
(4)AB装置中残留反应产生的二氧化碳气体未被C中的氢氧化钠吸收;
(5)①用不含二氧化碳的空气排出AB装置中原有的空气;②用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体;
(6)98.1%;(7)稀盐酸挥发出氯化氢气体,被C装置吸收,影响实验测定;
(8)避免AB装置中原来空气中二氧化碳气体对实验的干扰.
点评 本题容易出错的地方是第(5)小题,要知道通入不含有二氧化碳空气的目的,只有将生成的二氧化碳全部吸收才能使结果更准确.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:初中化学 来源: 题型:选择题
| A. | 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 | |
| B. | 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有C和H | |
| C. | 因为单质是由一种元素组成的,所以由一种元素组成的物质一定是单质 | |
| D. | 因为金属铁、镁能在氧气中燃烧,所以所有金属都能在氧气中燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
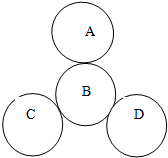 如图,A、B、C、D、各代表铝、稀盐酸、氧气、硫酸铜溶液四种物质中的一种.常温下,相切物质间能发生反应,不相切物质间不能发生反应且A为单质,D溶液为蓝色
如图,A、B、C、D、各代表铝、稀盐酸、氧气、硫酸铜溶液四种物质中的一种.常温下,相切物质间能发生反应,不相切物质间不能发生反应且A为单质,D溶液为蓝色查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | C的化学式为A3B | |
| B. | 若mg A2和ngB2恰好完全反应,则生成(m+n)g C | |
| C. | 若A2和B2的相对分子质量分别为X和Y,则C的相对分子质量为(X+Y) | |
| D. | 若ag A2完全反应生成bg C,则同时消耗(a-b)g B2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
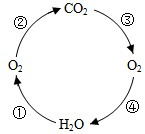 2011年11月,国家环境保护部对外公布《环境空气质量标准》和《环境空气质量指数日报技术规定》征求意见稿,
2011年11月,国家环境保护部对外公布《环境空气质量标准》和《环境空气质量指数日报技术规定》征求意见稿,| 序号 | 反应类型 | 化学方程式 |
| ① | 分解反应 | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
| ② | 化合反应 | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②③④ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com