
下图为某化工企业生产流程示意图:
下列说法正确的是
| A.钛酸亚铁(FeTiO3)中钛元素为+3价 |
| B.①中反应方程式为:2FeTiO3+6C+7Cl2一定条件2X+2TiCl4+6CO,则X为FeCl3 |
| C.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 |
| D.③中氩气(Ar)作保护气,反应类型为复分解反应 |
B
解析试题分析:A.设FeTiO3中Ti的化合价是x.FeTiO3中Fe的化合价是+2价,O的化合价是-2价,利用化合物中各元素的化合价的代数和为零的原则可得(+2)+x+(-2)×3=0,解得x="+4" 所以钛酸亚铁(FeTiO3)中钛元素的化合价是+4价,故说法错误;B.根据质量守恒定律,在反应前后各元素原子的个数不变.从2FeTiO3+6C+7Cl2═2X+2TiCl4+6CO看钛原子、氧原子、碳原子反应前后除物质x外个数已经相等,故x中无钛原子、氧原子、碳原子;反应前铁原子为2个,反应后只有x有,所以2x中有2个,从而x中有1个;反应前氯原子有14个,反应后x除外有8个,所以2x中有6个,因此x中有3个,因此x的化学式是FeCl3,故说法正确;C. 根据从化学方程式CO+2H2═CH3OH,结合化学方程式的意义可知一氧化碳和氢气的质量比是:28:4=7:1,故说法错误;D.由图示可知,TiCl4与Mg反应的反应物是TiCl4与Mg,生成物是Ti和MgCl2,该反应符合“单+化→单+化”的特点,为置换反应,故说法错误.
考点:物质的相互转化和制备;元素化合价的计算;基本反应类型;质量守恒定律及其应用


科目:初中化学 来源: 题型:探究题
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)
(1)甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是 浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量 得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水), (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
| 方案 | 优 点 |
| 甲组 | |
| 乙组 | |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
铬(Cr)是一种重要的金属材料,它具有良好的金属光泽和抗腐蚀性,常用来镀在其他金属的表面上,铜、铬、锰、镍组成合金可以制成各种性能的不锈钢。某校化学研究小组对Cr(铬)、Al、Cu的金属的活动性顺序进行探究,过程如下:
(1)[作出假设]对三种金属的活动性顺序提出三种可能的假设是:
①Cr>Al>Cu②Al>Cr>Cu③Cr>Cu>Al
[设计实验]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象,记录以下:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
(7分)金属材料在我国建设中起着重要的作用。
(1)钢铁舰身的锈蚀主要是铁与空气中的_______共同作用的结果。
(2)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为 。
(3)回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后
可得到铜和硫酸亚铁溶液,主要流程如下。
已知:CuO + H2SO4 CuSO4 + H2O
Fe + Fe2(SO4) 3 3FeSO4
① 过程Ⅰ中氧化铁发生反应的化学方程式是________。
② 过程Ⅱ充分反应后,还应有的实验操作是_______。
③ 过程Ⅲ加入适量A,发生反应的化学方程式是________。
④ A~F中含铁元素的有 (填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
某金属加工厂有大量金属铝、铁、铜的废弃粉末,为充分利用金属资源,分离
和回收金属,某化学兴趣小组通过查阅资料设计了如下实验方案: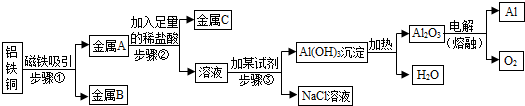
请完成下列各题:
(1)步骤①中分离得到的金属B是 。
(2)步骤②中所需的主要操作是 。
(3)步骤③生成沉淀的化学反应方程式是 ;
因Al(OH)3既能与酸反应又能与碱反应,步骤③逐滴加入试剂至 为止。
(4)电解熔融Al2O3制金属铝的化学方程式是 。
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式 ,盛水的铁锅与水面接触的一圈最易生锈,钢铁生锈的条件是 ,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的 (填字母)。
| A.耐腐蚀性 | B.延展性 | C.导热性 | D.导电性 |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
(3分) 如下图是某同学设计的趣味实验装置,气密性良好。
写出甲仪器的名称_____________________。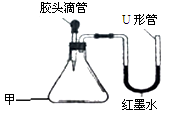
若胶头滴管中是NaOH溶液,要使U形管出现左高右低,则甲中的气体物质为____________。(写化学式)
若胶头滴管中是水,要使U形管出现左低右高,而后恢复相平的现象,则甲中的固体物质可能是_______________。(写化学式)
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
(12分)碱式碳酸盐广泛应用于工农业生产。
(1)某碱式碳酸盐样品M(OH)2·MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油中溶解CO2产生的影响)。
①连接装置并 ;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是 ,少量植物油的作用是 ,C中的试剂是 (填字母序号);
a.碱石灰 b.浓硫酸 c.硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管 (填“缓慢上移”或“缓慢下移”)。
Ⅳ.若其他操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是 (填字母序号);
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)实际生产中的碱式碳酸铜可表示为Cu(OH)2·mCuCO3,某研究小组仍使用上述装置测定m的值,测得3组数据如下表所示。取3组数据的值得到CO2的体积为 mL,又知常温常压下CO2的密度为1.964 g/L,据此计算m的值。(写出计算m的过程,最后结果保留小数点后两位) 。
| 组别 | 样品质量 | CO2体积 |
| 第1组 | 0.21 g | 22.39 mL |
| 第2组 | 0.21 g | 22.41 mL |
| 第3组 | 0.21 g | 22.40 mL |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
黑龙江省是我国主要的大豆产区,如图是某生产基地收获的大豆。请回答问题:
大豆加工成的豆制品是我们餐桌常见的食物,其所提供的主要营养素的作用是(1)
大豆在生长的过程中,为了防止大豆倒伏,和叶子的边缘发黄,需要施加的化肥是(2) (填化肥种类)长期使用这种类中的某一化肥,会使土壤酸化板结,该物质是(3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com