
【题目】高铁酸钾(K2FeO4)是一种具有氧化、吸附、凝聚、杀菌等功能的新型、高效水处理剂。在水体净化的过程中不产生任何有毒、有害的物质,具有广阔的研究开发前景。如图所示是以铁屑为原料制备K2FeO4的工艺流程图:
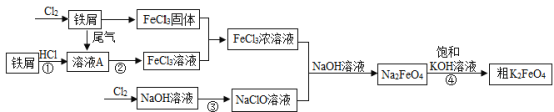
(1)溶液A中溶质的化学式为_____________________。
(2)写出步骤②发生反应的化学方程式_____________________。
(3)向氢氧化钠溶液中通入氯气,二者反应生成NaClO和一种厨房常用调味品以及一种由两种元素组成,质量比为1:8的物质,该反应的化学方程式为_____________________。
(4)步骤④发生的是复分解反应,说明Na2FeO4的溶解度比K2FeO4的溶解度_____________________(填“大”或“小”)。
【答案】FeCl2 ![]()
![]() 大
大
【解析】
步骤①为铁屑与稀盐酸的反应,该反应生成溶液A(氯化亚铁溶液);步骤②为溶液A(氯化亚铁)和尾气反应生成氯化铁,根据质量守恒定律可知,该尾气应为氯气;题中给出的是氯气与氢氧化钠发生的反应,根据质量守恒定律可知,反应物中只含有H、O、Na、Cl四种元素,根据所给信息即可判断生成物的化学式。
(1)溶液A为铁屑与稀盐酸反应生成的氯化亚铁溶液;
(2)尾气为氯气,氯气与氯化亚铁反应生成氯化铁,化学方程式:![]() ;
;
(3)由化学反应前后元素种类不变,可知氯气与氢氧化钠溶液反应生成次氯酸钠、氯化钠和水,其中氯化钠是厨房常用的调味品,水中氢、氧元素的质量比1:8,反应方程式:![]() 。
。
(4)复分解反应发生的条件是有气体或水或沉淀生成,由此可知Na2FeO4的溶解度大于K2FeO4的溶解度。


科目:初中化学 来源: 题型:
【题目】根据如图回答问题:
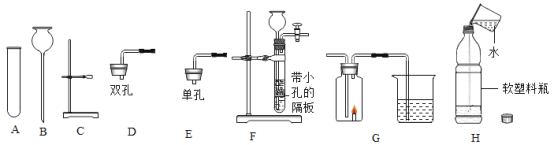
(1)实验室用锌粒和稀硫酸制取氢气,发生装置可选择图中的________(填仪器字母)进行组装,反应的化学方程式为_______________。
(2)某同学连接F、G进行实验,G中所加药品为澄清石灰水。若实验时观察到_______,证明由F制得的气体是CO2;将F中制得的CO2装满在软塑料瓶中,加入约![]() 体积的水,立即旋紧瓶盖,振荡,可能观察到的现象是_______________。
体积的水,立即旋紧瓶盖,振荡,可能观察到的现象是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生活、生产中应用广泛。请回答下列问题:
(1)合金比纯金属的利用更广泛,主要原因是_____ (答一点)。
(2)钢铁材料可以通过铁矿石冶炼生产。请写出工业用赤铁矿炼铁的化学方程式_____。
(3)世界上每年因锈蚀而损失的金属数量巨大。金属资源的保护和回收利用成为科学研究中的重大课题。用含较多铁锈的废铁屑制作动物饲料中的添加剂硫酸亚铁晶体的工艺流程如图所示[已知![]() ]:
]:
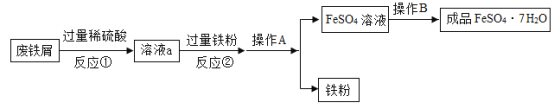
a.操作A的名称是_____。
b.溶液a中的溶质为_____。
c.反应②加入过量铁粉的目的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属是一种重要的自然资源,回答下列有关金属的问题。
(1)生铁和钢性能不同的原因是_______;
(2)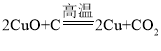 反应中,CuO发生_____反应(填“氧化”或“还原”);
反应中,CuO发生_____反应(填“氧化”或“还原”);
(3)把镁粉和锌粉的混合物放入硝酸银溶液中,充分反应,过滤,得到滤渣和滤液,取滤渣加盐酸,产生气泡,滤渣中一定含有的物质有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲物质的溶解度曲线如图所示,下列有关说法正确的是()
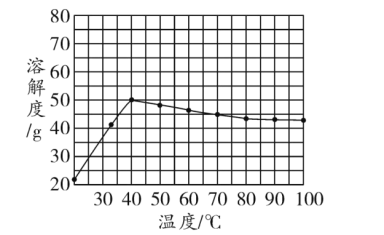
A.40°C时,100 g溶液中最多含有50 g甲物质
B.甲物质的溶解度随温度的升高而增大
C.100°C时,降低甲物质饱和溶液的温度,一定会有晶体析出
D.70°C时,甲物质饱和溶液的浓度约为31%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KCl和KNO3的溶解度曲线如图所示。下列说法正确的是
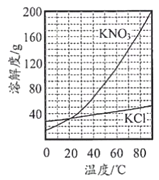
A. 10℃时, KNO3的溶解度比KCl的大
B. KNO3的溶解度受温度的影响比KCl的大
C. 随着温度的升高,KCl的溶解度逐渐减小
D. 40℃时KNO3的饱和溶液,升温至60℃时仍是饱和溶液(忽略水分挥发)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】试根据图中信息回答下列问题。

(1)品红在热水中扩散比冷水快的原因_____。
(2)随着工业的发展,排放到空气中的_____和_____对空气造成了污染;
(3)此实验中水的作用是_____。
(4)二氧化锰对过氧化氢的分解具有_____作用;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),其生产流程和相关物质的溶解度曲线及溶解度数据如图(假设流程中反应恰好完全进行):
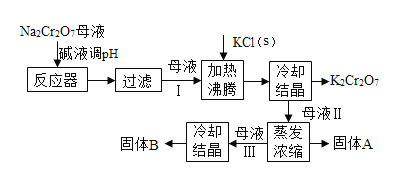
物质 | 溶解度(g/100g H2O) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
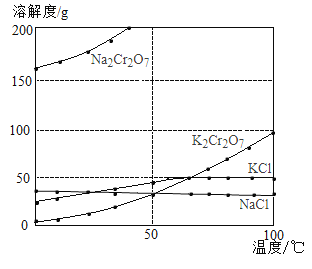
(1)由溶解度曲线可知,50℃时,K2Cr2O7、KCl、NaCl三种物质溶解度的大小关系为_____________,100℃时,用等质量的K2Cr2O7、KCl、NaCl三种固体配制成饱和溶液,溶液质量大小关系为_____________。
(2)将40℃四种物质的饱和溶液降温至0℃,溶质质量分数最小的是______________。
(3)加碱液调节pH的目的是____________。
(4)加入氯化钾固体后,反应的化学方程式为___________。根据溶解度数据可知,该反应能够发生的原因是____________。
(5)流程中要得到母液Ⅲ和固体A的操作为___________,蒸发浓缩原因是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用“![]() ”和“
”和“![]() ”分别代表两种不同单质A2和B2分子,A2和B2在一定条件下发生化学反应,其反应的微观示意图如下,下列说法正确的是()
”分别代表两种不同单质A2和B2分子,A2和B2在一定条件下发生化学反应,其反应的微观示意图如下,下列说法正确的是()
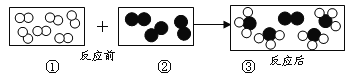
A.在反应过程中分子保持不变
B.该反应为化学变化
C.参加反应的A2和B2分子数之比为3:2
D.生成物有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com