

分析 (1)熟记仪器的名称;
(2)根据实验室制取二氧化碳的原装置以及方程式计算即可;
(3)根据实验室制取气体和收集气体的方法来分析.
解答 解:(1)仪器A的名称是试管;故填:试管;
(2)①石灰石的主要成分是碳酸钙,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,配平即可,故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②利用石灰石与稀盐酸反应制取二氧化碳,是固体与液体在常温下反应,并用向上排空气法来收集,需要用到的仪器有B、C、F、G、H;故填:C;
③设需要7.3%的稀盐酸的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
73 44
7.3%x 8.8g
$\frac{73}{44}=\frac{7.3%x}{8.8g}$
x=200g
故填:200;
(3)气体的制取装置的选择与反应物的状态和反应的条件有关.故填:反应条件.
点评 本考点主要考查了仪器的名称、检查装置的气密性,同时也考查了化学方程式的书写,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
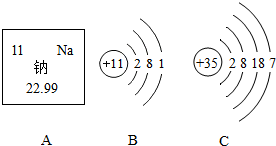 如图A是钠元素在周期表中的相关信息,B是钠元素原子结构示意图,C是溴元素(Br)原子结构示意图,回答问题.
如图A是钠元素在周期表中的相关信息,B是钠元素原子结构示意图,C是溴元素(Br)原子结构示意图,回答问题.查看答案和解析>>
科目:初中化学 来源:2017届湖北省九年级下学期第二次月考化学试卷(解析版) 题型:简答题
某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾不饱和溶液100g。
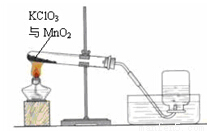
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(1)共制得氧气 g。
(2)计算所得氯化钾溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源:2017届湖北省九年级下学期第二次月考化学试卷(解析版) 题型:选择题
如图为晶体M(不含结晶水)的溶解度曲线,a、b两点分别表示M物质的溶液。下列有关说法或a、b间的转化方法错误的是
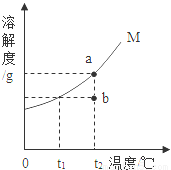
A.t2℃时,a是饱和溶液,b是不饱和溶液
B.将两份溶液温度降到t1℃时,a、b中都有晶体析出
C.从a→b:先将a降温到t1℃,过滤后将滤液升温到t2℃
D.从b→a:在b中加入M至刚好饱和
查看答案和解析>>
科目:初中化学 来源:2017届江苏省苏州市区九年级一模调研测试化学试卷(解析版) 题型:信息分析题
黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量进行了如下的实验探究(假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
Ⅰ. 称取2.40 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
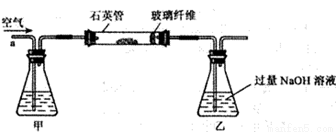
Ⅱ. 反应结束后,将乙瓶中的溶液进行如下处理:

【问题讨论】
(1)Ⅰ装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是______________。
(2)Ⅰ装置中乙瓶内发生反应的化学反应方程式是____________________。
【含量测定】
(3)计算该黄铁矿中FeS2的质量分数__________________。(请写出计算过程)
【交流反思】
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会________________(填“偏大”“偏小”或“不变”)。
(5)Ⅱ中检验滤渣是否洗涤干净的方法是,取最后一次洗涤液,加入_____________,说明已洗涤干净。
【拓展应用】
工业上以黄铁矿为原料生产硫酸的工艺流程图如下所示:

(6)接触室中发生反应的化学方程式为________________________。化学实验室常需要用到较稀的硫酸,把浓硫酸稀释的操作是_______________________________________,硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途______________________。
(7)依据生产硫酸的工艺流程图,下列说法正确的是_______________(填字母)。
A.为使黄铁矿充分燃烧,需将其粉碎 B.催化剂能够提高SO2的反应速率和产量
C.沸腾炉排出的矿渣可供炼铁 D.吸收塔中为了提高吸收效率,采用喷淋的方式
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁条在空气中燃烧,发出白色火焰,生成白色粉末 | |
| B. | 细铁丝在空气中剧烈燃烧,火星四射,放热,生成一种黑色固体 | |
| C. | 硫在氧气中燃烧发出蓝紫色火焰,放热,生成有刺激性气味的二氧化硫 | |
| D. | 木炭在空气中燃烧,放热,发出红光 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com