
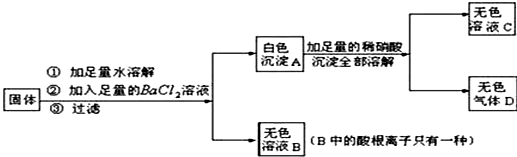
分析 根据白色沉淀可以溶于硝酸生成气体的性质即可判定它是碳酸钡,以此为突破口,逐一分析,即可正确解答.白色固体加足量水,加;氯化钡溶液过滤,得到无色滤液B和白色沉淀A,硫酸铜溶于水呈蓝色,碳酸钠和氯化钡反应生成碳酸钡沉淀,硫酸钠与氯化钡反应产生硫酸钡沉淀,因此白色固体中一定不含CuSO4,沉淀可能是碳酸钡或硫酸钡或二者都有;因白色沉淀加足量稀硝酸,沉淀全部溶解且生成无色气体,说明沉淀是碳酸钡,则白色固体中一定含有碳酸钾和碳酸钠,一定不含Na2SO4;向无色滤液B中酸根离子只有一种,因此原白色固体中可能含有氯化钠,则一定不含有KNO3.(3)通过实验和计算可知该白色固体中只含NaCl、Na2CO3.
解答 解:(1)Na2SO4和Na2CO3都可与BaCl2发生反应,分别生成硫酸钡和碳酸钡沉淀,但硫酸钡不溶于硝酸,而碳酸钡与硝酸反应生成硝酸钡、水和二氧化碳.故无色气体D为二氧化碳,其化学式为CO2;
(2)由(1)①的分析可知,原固体中一定含有碳酸钠,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,硫酸铜溶于水呈蓝色,由图示可知“无色溶液B中的酸根离子只有一种”,故原固体中可能含有氯化钠,则一定不含有 CuSO4、Na2SO4,KNO3.
(3)②中加入足量的Ba(NO3)2溶液,碳酸钠、碳酸钾与Ba(NO3)2溶液反应,除去碳酸根离子.
滤液加入AgNO3溶液,观察到有白色沉淀生成,说明固体中一定有氯化钠.
设得到4.4g二氧化碳需要碳酸钾的质量为x
K2CO3+2HCl═2KCl+H2O+CO2↑
138 44
x 4.4g
$\frac{138}{x}=\frac{44}{4.4g}$
x=13.8g
同理算出得到4.4g二氧化碳需要碳酸钾的质量为10.6g,由于固体中一定有氯化钠,而生成4.4g二氧化碳所需要碳酸钾的质量为13.8g,
所以,固体中一定不含K2CO3,能只含氯化钠、碳酸钠.
故答案为:(1)CO2;(2)CuSO4、Na2SO4,KNO3;(3)除去碳酸根离子 NaCl、Na2CO3.
点评 此题主要是考查同学们的综合分析能力,不但要求同学们具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:初中化学 来源: 题型:选择题
| A. | 28.75% | B. | 25% | C. | 56% | D. | 71.25% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用pH试纸测得溶液的pH为9.5 | B. | 用100mL的量筒取8.5mL的水 | ||
| C. | 用托盘天平称量5.85g食盐 | D. | 熄灭酒精灯用灯冒盖灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com