用15.8g KMnO4与12mol/L的 浓HCl发生.反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 通过计算解答以下问题:
(1)KMnO4能使多少毫升浓HCl发生上述反应?
(2)被氧化的HCl的物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?电子转移总数为多少?
【答案】
分析:先算出高锰酸钾的物质的量,然后写出化学方程式并代入数据可以计算出氯化氢和氢气的物质的量,需要注意的是:被氧化的HCl的物质的量占总的HCl的物质的量

(

).
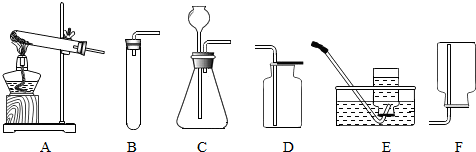
解答:解:KMnO
4的物质的量=
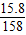
=0.1,设需要HCl的物质的量是Xmol,生成Cl
2的物质的量是Ymol.
2KMnO
4+16HCl=2KCl+2MnCl
2+5Cl
2↑+8H
2O
2 16 5
0.1 X Y
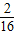
═

得:X=0.8

═
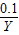
得:Y=0.25
∴浓HCl溶液的体积=

=0.067L=66.7mL.
∵根据氧化反应的概念可知,元素的化合价升高被氧化,Cl元素的化合价一部分升高,一部分不变,所以HCl是部分被氧化.从化学方程式可以看出,16个Cl原子中有10个原子的化合价升为0价,因此被氧化的HCl占总的HCl的
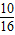
,因此被氧化的HCl的物质的量=0.8×
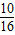
=0.5mol.
∴Cl
2在标准状况下的体积=0.25×22.4=5.6L.
∵一个Cl原子化合价从-1价升高到0价需要失去1个电子,被氧化的HCl的物质的量是0.5mol,所以电子转移总数(失去电子数)=0.5×1=0.5mol
答:KMnO
4能使66.7毫升浓HCl发生上述反应,被氧化的HCl的物质的量为0.5mol,产生的Cl
2在标准状况下的体积为5.6L,电子转移总数为0.5mol.
点评:本题容易出错的地方是:被氧化的HCl的物质的量和HCl的物质的量不一样,电子转移个数等于失去电子个数.

 (
( ).
).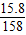 =0.1,设需要HCl的物质的量是Xmol,生成Cl2的物质的量是Ymol.
=0.1,设需要HCl的物质的量是Xmol,生成Cl2的物质的量是Ymol.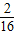 ═
═
 ═
═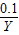
 =0.067L=66.7mL.
=0.067L=66.7mL.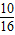 ,因此被氧化的HCl的物质的量=0.8×
,因此被氧化的HCl的物质的量=0.8×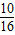 =0.5mol.
=0.5mol.