
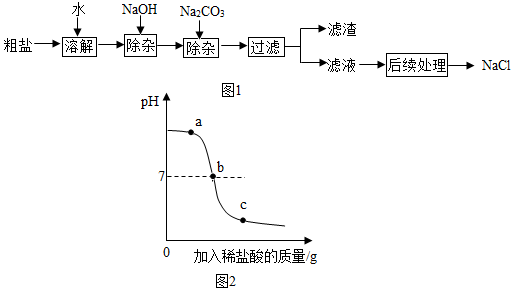
分析 (1)根据物质的微观构成分析;
(2)根据给出的除杂流程分析发生的反应以及加入试剂的目的;
(3)根据发生的反应以及对应的点进行分析;
(4)根据生成的二氧化碳的质量和对应的化学方程式求算碳酸钠的质量,进而求算其质量分数.
解答 解:(1)食盐主要成分为氯化钠,氯化钠是由 Na+和Cl-构成.
(2)
①除杂时加入氢氧化钠时为了除去氯化镁,对应的反应为氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠;加入碳酸钠的目的是除去氯化钙,对应的反应是氯化钙和碳酸钠反应生成碳酸钙和氯化钠,对应的化学方程式为 MgCl2+2NaOH=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl.
②本实验中加入Na2CO3是为了除去 氯化钙,为避免引入新的杂质,而实验最终要得到纯净的氯化钠,所以去除过量的NaOH和Na2CO3可加足量的稀盐酸.
(3)向氢氧化钠溶液中不断滴入盐酸,由于加入盐酸生成了氯化钠,而a点时溶液显碱性也就是有剩余的氢氧化钠,所以此时溶液中的溶质是生成的氯化钠和剩余的氢氧化钠
(4)设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 3.3g
$\frac{106}{44}$=$\frac{x}{3.3g}$
x=7.95
该食用纯碱中碳酸钠的质量分数为$\frac{7.95g}{10g}$×100%=79.5%
故答案为:
(1)Na+和Cl-;
(2)①MgCl2+2NaOH=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl.
②氯化钙;稀盐酸.
(3)氯化钠和氢氧化钠.
(4)设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 3.3g
$\frac{106}{44}$=$\frac{x}{3.3g}$
x=7.95
该食用纯碱中碳酸钠的质量分数为$\frac{7.95g}{10g}$×100%=79.5%
答:该食用纯碱中碳酸钠的质量分数为79.5%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 加入氯化钙溶液质量/g | 20.0 | 60.0 | 80.0 |
| 生成沉淀质量/g | 1.0 | m | 3.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示,在烧杯A中装入20mL蒸馏水,滴入2-3滴酚酞试液.在烧杯B中装入10mL浓氨水.然后用一只大烧杯把A、B两烧杯溶液罩在一起.过几分钟,可以观察到烧杯A中的溶液变成红色.通过上述现象,得出的结论有:分子是不断运动着的,浓氨水呈碱性(填“酸性”或“碱性”).还可以通过什么方法检测氨水的酸碱性呢?所用的药品的名称pH试纸,产生的现象是试纸由黄色变成蓝色.
如图所示,在烧杯A中装入20mL蒸馏水,滴入2-3滴酚酞试液.在烧杯B中装入10mL浓氨水.然后用一只大烧杯把A、B两烧杯溶液罩在一起.过几分钟,可以观察到烧杯A中的溶液变成红色.通过上述现象,得出的结论有:分子是不断运动着的,浓氨水呈碱性(填“酸性”或“碱性”).还可以通过什么方法检测氨水的酸碱性呢?所用的药品的名称pH试纸,产生的现象是试纸由黄色变成蓝色.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 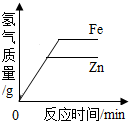 表示等质量的锌和铁分别与足量溶质质量分数相同的稀硫酸反应 | |
| B. | 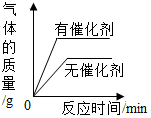 表示完全相同的两份过氧化氢溶液在有、无催化剂条件下的分解 | |
| C. | 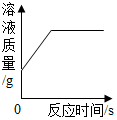 表示向一定量硫酸铜溶液中加入一定量锌粉 | |
| D. | 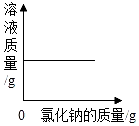 表示向一定量的饱和氯化钠溶液中加入硝酸钾固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 27-A | 27-B |
| (1)农业上用10%~20%的NaCl溶液进行选种.现要配制15%的NaCl溶液200kg,需要NaCl和水的质量分别是30kg,170kg. (2)氯化钠是由离子(填“分子”“原子”或“离子”)构成. | (1)一定质量分数的KNO3溶液可用作无土栽培的营养液.现将100kg溶质质量分数为15%的KNO3溶液中加水400kg,溶液中溶质质量分数为3%. (2)KNO3为复合肥料,是因为KNO3为植物生长提供了必需的氮和钾元素. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com