
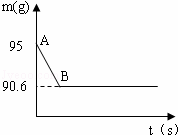
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数):
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中CaCO3的质量分数.
(3)所用稀盐酸中溶质的质量分数.
| 根据化学反应方程式的计算;有关溶质质量分数的简单计算;质量守恒定律及其应用.. | |
| 专题: | 压轴实验题;溶液的组成及溶质质量分数的计算;有关化学方程式的计算. |
| 分析: | (1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,生成的二氧化碳扩散到空气中,烧杯中前后减少的质量即为二氧化碳的质量. (2)根据二氧化碳的质量求出碳酸钙的质量,再根据 (3)根据二氧化碳的质量求出一半稀盐酸中溶质的质量,再根据 |
| 解答: | 解:(1)产生CO2的质量为:95g﹣90.6g=4.4g 故答案为:4.4g (2)设鸡蛋壳中碳酸钙的质量为x,一半稀盐酸中溶质的质量为y. CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 73 44 x y 4.4g
(3)稀盐酸中溶质的质量分数= |
| 点评: | 石灰石与稀盐酸反应,反应前后减少的质量为二氧化碳的质量,固体在反应前后减少的质量为参加反应的碳酸钙的质量,要将两者区分清. |


科目:初中化学 来源: 题型:
用化学用语填空:
(1)地壳中含量最多的金属元素__ __; (2)导电性最好的金属__  __;
__;
(3)3个铵根离子____ ; (4)碳酸钡中钡元素显+2价_ __;
(5)磁铁矿的主要成分_ ___; (6)白酒中的溶质___ _。
查看答案和解析>>
科目:初中化学 来源: 题型:
|
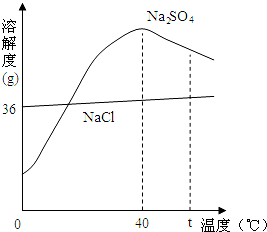
| A. | 氯化铵的溶解度最大 |
|
| B. | 随着温度升高,硫酸钠的溶解度不断增大 |
|
| C. | 40℃时硫酸钠饱和溶液溶质的质量分数为50% |
|
| D. | 把40℃时相同质量的饱和溶液降温到20℃,硫酸钠析出晶体最多 |
查看答案和解析>>
科目:初中化学 来源: 题型:
配制一定溶质质量分数的溶液:固体配制:计算、称量(或量取)、溶解.现有下列仪器:A.托盘天平B.量筒C.酒精灯D.药匙E.胶头滴管 F.玻璃棒 G.烧杯.欲将98%的浓硫酸稀释成20%的稀硫酸,实验中不需要用到的仪器有 (填序号).
查看答案和解析>>
科目:初中化学 来源: 题型:
在部分地区发生“抢盐”风波后,我国政府及时发布公告称:核事故对我国海域污染可能性极小,且我国85%以上的食盐是湖盐(来自内陆盐湖)而不是海盐.已知:盐湖原盐主要成分是NaCl,还含有泥沙和芒硝等.右图为芒硝和氯化钠的溶解度曲线.请回答:
(1)将t℃饱和硫酸钠溶液降温至40℃时,溶液中 (填“有”、“没有”)晶体析出.
(2)为除去原盐中的泥沙,可先将原盐溶解,再通过 操作除去.
(3)可用“夏季采盐,冬季捞硝”的方法来分离湖水中的芒硝和食盐.这种方法的化学原理是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com