

分析 (1)根据铜可以拉成铜丝,这是利用金属的延展性进行解答;
(2)根据铝具有很好的抗腐蚀性能,原因是铝和氧气生成致密的氧化铝薄膜进行解答;
(3)根据合金要比组成它的纯金属的硬度大解答;
(4)从赤铁矿和一氧化碳在高温条件下生成铁和二氧化碳去分析;
(5)根据反应前后元素种类不变考虑;
(6)根据题中信息结合化学方程式的书写步骤解答.
解答 解:
(1)铜可以拉成铜丝,这是利用金属的延展性;
(2)铝具有很好的抗腐蚀性能,原因是铝和氧气生成致密的氧化铝薄膜,化学方程式为4Al+3O2=2Al2O3;
(3)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大;
(4)赤铁矿和一氧化碳在高温条件下生成铁和二氧化碳,该反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(5)化学反应前后元素种类不变,碱式碳酸铜中含有碳元素和氢元素,所以铜生锈时一定有含有碳元素和氢元素的物质参加,空气中含碳的物质是二氧化碳,含氢元素的物质是水,所以铜生锈是铜与氧气、水、二氧化碳共同作用的结果.
根据铜生锈是铜与水、氧气和二氧化碳共同作用的结果;
(6)H2还原FeCl2置换出铁的化学方程式为:H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
答案:
(1)延展性
(2)4Al+3O2═2Al2O3
(3)黄铜的硬度比纯铜的大
(4)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(5)水、CO2
(6)H2+FeCl2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl
点评 解答本题要掌握化学方程式的书写方法和金属与合金的性质等方面的知识,只有这样才能对相关方面的问题做出正确的判断.


 考前必练系列答案
考前必练系列答案科目:初中化学 来源: 题型:填空题
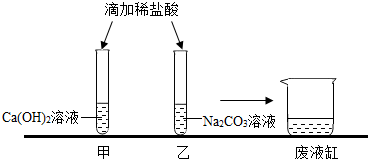 甲、乙同学在学完酸的化学性质后,做了如下实验:
甲、乙同学在学完酸的化学性质后,做了如下实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
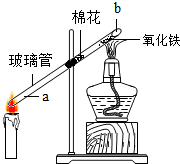
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
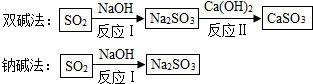
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.90 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在pH=2的溶液中:KCl、Na2SO4、HNO3 | |
| B. | 在pH=1的溶液中:NaCl、Na2CO3、Na2SO4 | |
| C. | 在pH=13的溶液中:BaCl2、Na2CO3、NaOH | |
| D. | 在pH=14的溶液中:FeCl3、Ba(NO3)2、CaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
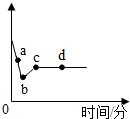 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )| A. | 取a点溶液,滴加稀盐酸,无白色沉淀 | |
| B. | c点溶液中溶质为Zn(NO3)2 | |
| C. | 若取b~c段固体,滴加稀盐酸,无气泡产生 | |
| D. | 取d点的固体有2种 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com