
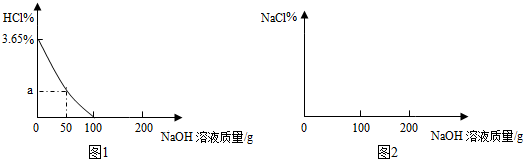
分析 氢氧化钠和稀盐酸反应生成氯化钠和水,根据反应的化学方程式和提供的数据可以进行相关方密度计算和判断.
解答 解:(1)据图1分析:加入氢氧化钠溶液100g时与100g稀盐酸恰好完全反应.
故填:100.
(2)设加入50g氢氧化钠溶液时,反应的氯化氢质量为m,
HCl+NaOH=NaCl+H2O,
36.5 40
m 50g×4%
$\frac{36.5}{40}=\frac{m}{50g×4%}$
m=1.825g,
坐标中a点相应的值是:$\frac{3.65g-1.825g}{100g+50g}$×100%=1.22%,
答:坐标中a点相应的值是1.22%.
(3)当加入氢氧化钠溶液100g时,生成氯化钠的质量为x
HCl+NaOH=NaCl+H2O
40 58.5
4g x
$\frac{40}{58.5}=\frac{4g}{x}$
x=5.85g
氯化钠的质量分数为:$\frac{5.85g}{100g+100g}×100%$≈2.93%;
当加入氢氧化钠溶液200g时,氯化钠的质量分数为:$\frac{5.85g}{100g+200g}×100%$=1.95%;
故往盐酸中加入氢氧化钠溶液至200g”的变化曲线如下图所示: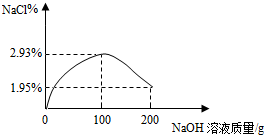
点评 本题是借助于数学模型,利用公式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:初中化学 来源: 题型:选择题
| A. | 二甲醚由9个原子构成 | |
| B. | 二甲醚中碳、氢、氧三种元素的质量比为2﹕6﹕1 | |
| C. | 2.3 g二甲醚中含碳元素的质量为1.2 g | |
| D. | 二甲醚和甲烷在氧气中完全燃烧的产物不相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 保存方法 | 原 因 |
| A | 生石灰应密封保存 | 生石灰易与空气中的氧气反应 |
| B | 浓盐酸应密封保存 | 浓盐酸在空气中易分解 |
| C | 烧碱应密封保存 | 烧碱易潮解且与空气中二氧化碳反应 |
| D | 白磷应保存在水中 | 白磷有剧毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可用于钻探 | B. | 属于有机合成材料 | ||
| C. | 可用于机械加工 | D. | 可用于刻划玻璃 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com