
【题目】为了测定大理石样品中钙元素的质量分数(杂质不含钙元素,不溶于水,也不与其他物质发生反应),进行了如下实验。请回答下列问题。
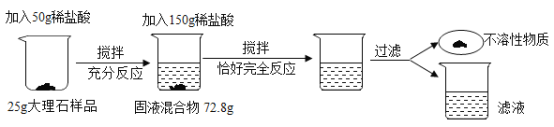
(1)上述实验过程中发生反应的化学方程式为____________________。
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质的质量(x)的比例式__________________。
(3)此大理石样品中钙元素的质量分数__________________。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需盐酸的质量为__________________。
(5)若将反应后的滤液蒸发11.2g水,无晶体析出,所得溶液中溶质的质量分数为______________。
(6)现有上述大理石样品500t,可以制得含杂质的生石灰的质量为__________________。
【答案】![]()
![]() 32% 40g 11.1% 324t
32% 40g 11.1% 324t
【解析】
(1)盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,书写化学方程式注意配平及气体符号;
故填:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)解:第一次50g稀盐酸完全反应生成二氧化碳为50g+25g-72.8g=2.2g,
设第一次所加的稀盐酸中溶质质量为x
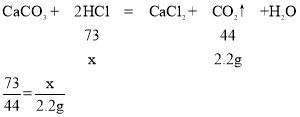
故填:![]() 。
。
(3)根据(2)中比例式,可以求得x=3.65g,加入150g稀盐酸,与之前的50g稀盐酸相同,所以150g稀盐酸中含有溶质的质量=3.65g×3=10.95g,稀盐酸一共含有溶质=10.95g+3.65g=14.6g,设样品中碳酸钙质量为m,
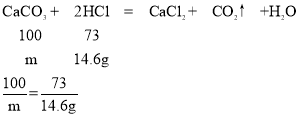
m=20g
其中钙元素质量=20g×![]() ×100%=8g,所以样品中钙元素质量分数=
×100%=8g,所以样品中钙元素质量分数=![]() ×100%=32%
×100%=32%
答:此大理石样品中钙元素的质量分数为32%。
故填:32%。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,设所需盐酸的质量为a
a×36.5%=14.6g
a=40g
答:所需盐酸的质量为40g。
故填:40g。
(5)设反应生成二氧化碳质量为y,生成氯化钙质量为z,
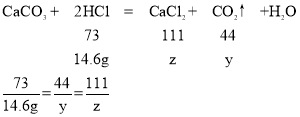
y=8.8g z=22.2g
所以滤液质量=200g+20g-8.8g=211.2g,此时蒸发11.2g水,溶液质量变为=211.2g-11.2g=200g
所以所得溶液中溶质的质量分数为![]()
答:所得溶液中溶质的质量分数为11.1%。
故填:11.1%。
(6)设生石灰质量为c,样品中碳酸钙质量分数=![]() ×100%=80%,所以此时碳酸钙质量=500t×80%=400t,
×100%=80%,所以此时碳酸钙质量=500t×80%=400t,
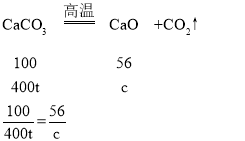
c=224t
杂质质量=500t-400t=100t,所以生成含杂质的生石灰质量=100t+224t=324t
答:可以制得含杂质的生石灰的质量为324t。
故填:324t。


科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习化学知识,请你一起参与探究性学习,并回答有关问题。
探究主题:水溶液中发生复分解反应的实质。
相关信息:一定体积的溶液中,离子的数目越多,其浓度越大。电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。相同温度下同种溶液电导率越大,离子浓度越大。
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2~3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示。
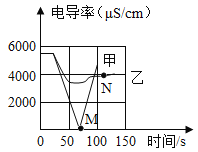
①写出反应的化学方程式:_______________。
②甲曲线M点时混合液体呈____________色。
③通过对甲曲线的分析,下列说法正确的是___________(填字母)。
A、M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4
B、M点时离子浓度几乎为零
C、M点后溶液电导率逐渐增大,仅由于溶液中H+数目在逐渐增大
(3)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2~3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如图乙曲线所示。
①通过对乙曲线的分析,下列说法错误的是___________(填字母)。
A、开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B、电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C、整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是_______________(填离子符号)。
③该实验中实际参加反应的离子是____________________。
实验结论:通过分析可知,溶液中发生复分解反应的实质是参与反应的离子结合生成了难电离的____________,导致溶液中的离子浓度_________(填“增大”或“减小”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组为了探究NH3在不同环境下与O2的反应,进行图1和图2两组实验,同学们根据图2实验中气体成分分析数据,绘制了如图3的曲线图。
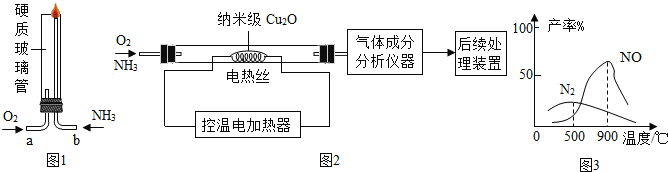
(查阅资料)
①氨气是一种有刺激性气味的气体,在高浓度氧气中才能燃烧,生成氮气和水;
②在纳米级Cu2O的催化作用下,氨气与氧气在不同的温度下发生以下不同的化学反应(表达式中条件已省略): 4NH3+5O2═4NO+6H2O ,4NH3+3O2═2N2+6H2O;工业上用NO制备硝酸、氮肥等化工产品。
请根据所给信息回答:
(1)图1实验过程中,要先通__________一段时间,再通入另一种气体并点燃,可以避免空气污染。
(2)氨气在高浓度氧气中燃烧的化学方程式为___________________________________。
(3)图2实验中,若后续处理装置是为工业制备硝酸提供NO,根据图3分析,最好将电热丝的温度控制在__________℃左右。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】进行如下二组微型实验,研究物质的性质。
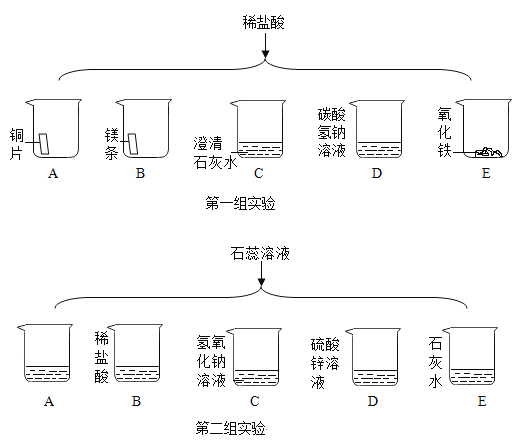
第一组实验中
(1)不能产生气泡的是________________(填序号)。
(2)能证明 E 中发生反应的现象是________________。
(3)有一只烧杯中的物质不与稀盐酸反应,原因是 ________________。
(4)除加指示剂外,设计证明澄清石灰水与稀盐酸发生反应的方法是_________________。
(5)第一组实验的目的是________________。
第二组实验中
(1)D 中溶液变为红色,说明硫酸锌溶液显___________________(填“酸性”或“碱性”)。
(2)B、C、D、E 溶液变为蓝色的有______________(填字母序号)。
(3)A 作为空白对照实验,则烧杯中的物质是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类、类比是初中化学常用的学习方法。初中化学有许多实验,若按照实验主要目的可将实验分为:物质发生化学反应条件的探究,物质性质的探究,物质含量的探究等。按实验目的将下列实验中的B与______(填字母)归为一类,分类的依据是______。
|
|
|
|
A | B | C | D |
(2)![]() 年,俄国学者贝开托夫
年,俄国学者贝开托夫![]() 在实验的基础上,根据金属和金属离子间互相置换的大小,以及金属跟酸、水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢。在金属活动性顺序中活动性越强,其金属的还原性也越强。确定金属的活动性也可以根据元素在元素周期表中的位置判断,如图是元素周期表的一部分。请回答下列问题。
在实验的基础上,根据金属和金属离子间互相置换的大小,以及金属跟酸、水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢。在金属活动性顺序中活动性越强,其金属的还原性也越强。确定金属的活动性也可以根据元素在元素周期表中的位置判断,如图是元素周期表的一部分。请回答下列问题。
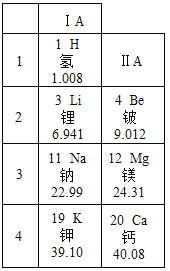
金属活动性顺序为:![]()
请推断金属铍的金属活动性比金属镁的活动性______(填“强”或“弱”);金属锂的还原性比金属镁的活动性______(填“强”或“弱”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中 A~I 为初中化学常见物质,且分别由 H、O、Cl、S、Fe、Cu、Al 中的一种或几种元素组成。F 在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能; 只有 G 由三种元素组成:A、B、C、F、I均为单质;H、G 类别相同;图中“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物及反应条件省略)。
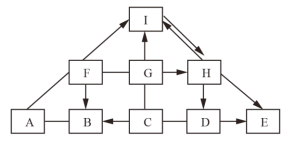
(1)写出 F 的化学式:______。
(2)写出 I→H 反应的化学方程式______。
(3)G 和 C 反应的基本反应类型为______。
(4)如 E 和F 含有同一种金属元素,写出 D→E 反应的化学方程式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E是初中化学中常见的物质,其中E是六大基本营养素之一。它们之间转化关系如图所示:
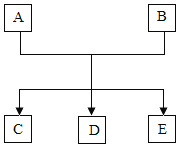
(1)若A是酸,C是食盐的主要成分,反应的化学方程式为__________。
(2)若在加热条件下,单质A能与B的浓溶液发生反应,且C溶液为蓝色,D会形成酸雨,D中组成元素的质量比为1∶1,则D的化学式为________。
(3)若A是碱,D是具有刺激性气味的气体,反应的化学方程式为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硅在集成电路中应用十分广泛,如图是元素在元素周期表中的相关信息及硅原子的结构示意图。下列说法错误的是
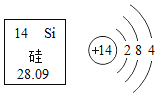
A.硅原子核内中子数为14
B.硅元素位于元素周期表的第三周期
C.硅原子在化学反应中既不易失电子,也不易得电子
D.硅是地壳中含量最高的非金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com