
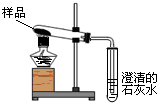
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加入适量的水使之溶解,往试管中滴加2滴无色酚酞溶液,观察现象 | 溶液变红 | 白色固体是氢氧化钠 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加入适量 |
试管中产生大量气泡 |
| 实验步骤 | 实验现象 | 实验结论 |
| ||
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加水充分溶解,加入足量的BaCl2溶液, | 有白色沉淀产生 | 白色固体是碳酸钠 |
| ||
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量残余固体于试管中,加水充分溶解,加入足量的BaCl2溶液, | 有白色沉淀产生 | 白色固体是碳酸钠 |


科目:初中化学 来源: 题型:
 某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如右图所示,请根据题意解答问题:
某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀硫酸,测得反应放出气体的总质量与所加入稀硫酸的质量关系曲线如右图所示,请根据题意解答问题:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
阴离子 阳离子 |
OH- |
SO42- |
Cl- |
| Cu2+ | 不 | 溶 | 溶 |
| Ni2+ | 不 | 溶 | 溶 |
| Cr3+ | 不 | 溶 | 溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 1 | 2 | 3 | |
| 石料质量/g | 50 | 50 | 100 |
| 稀盐酸质量/g | 240 | 300 | 200 |
| CO2气体质量/g | 17.6 | 17.6 | 17.6 |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年新人教版九年级(上)期中化学模拟试卷(9)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com