
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
分析 在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂.要探究一种物质能否作为化学反应的催化剂,一般要注意从三个方面入手进行:一是探究加入该物质能否改变化学反应速率;二是探究反应前后该物质的质量是否改变;三是探究化学反应前后该物质的化学性质是否改变.
解答 解:通过实验一探究Al2O3对过氧化氢分解速率的影响.实验1的步骤是:将带火星的木条伸入装有过氧化氢溶液的试管中,带火星的木条不复燃,可见常温下过氧化氢分解速率很慢.然后在装有过氧化氢溶液的试管中加入少量Al2O3,带火星的木条复燃,可见,Al2O3能加快过氧化氢的分解速率.但不能说Al2O3就是过氧化氢的催化剂.
实验三:通过实验前后两次称量,可知实验三是探究Al2O3在反应前后质量是否改变.将实验二反应后的物质进行过滤可得到Al2O3,必须经过洗涤、烘干后才称量,减少实验数据的误差.
最后,还必须在增加一个实验:探究Al2O3的化学性质在反应后是否改变.只有Al2O3具备既能改变化学反应速率,其质量和化学性质在反应前后又保持不变,才能作为过氧化氢分解的催化剂.
故答案为:【实验验证】
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | ||
| 实验二 | Al2O3能加快过氧化氢的分解速率 |
点评 此题探究Al2O3是不是过氧化氢分解反应的催化剂.中考有关催化剂的考查主要集中在催化剂的作用和探究某物质是不是过氧化氢或氯酸钾分解反应的催化剂.催化剂的特点可以概括为“一变二不变”,一变是能够改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变.要探究一种物质能否作为化学反应的催化剂,必须同时具备上述特点.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
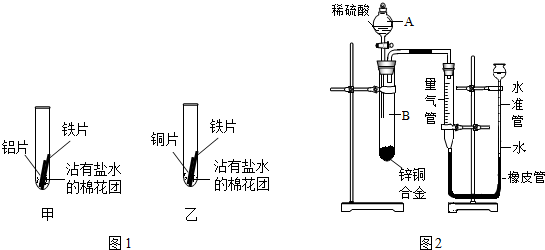
| 现象 | 分析 |
| 甲中:铝片表面出现灰白色物质,铁片表面几乎没有明显现象. | 铝与铁在潮湿的环境中接触,铝首先被腐蚀. |
| 乙中:铁片表面出现红棕色固体,铜片表面几乎没有明显现象. | 铁与铜在潮湿的环境中接触,铁首先被腐蚀. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  稀释等质量的30%H2SO4和10%H2SO4溶液 稀释等质量的30%H2SO4和10%H2SO4溶液 | |
| B. |  往等质量的Na2CO3和NaHCO3固体中加入足量HCl溶液 往等质量的Na2CO3和NaHCO3固体中加入足量HCl溶液 | |
| C. |  将等质量的Mg和Fe投入到足量稀H2SO4中 将等质量的Mg和Fe投入到足量稀H2SO4中 | |
| D. |  电解水 电解水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将铅笔芯粉末放入锁芯,使开锁更灵活 | |
| B. | 用食醋制无壳鸡蛋 | |
| C. | 用小卵石、石英砂、活性炭等制简易净水器 | |
| D. | 用石蕊检验硬水和软水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com