
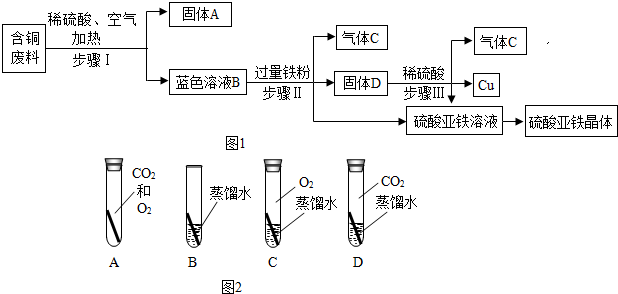
分析 根据设计方案图1可知,废料中的铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水,所以蓝色溶液中的溶质中含有硫酸铜,根据蓝色溶液中加入铁有气体产生,说明蓝色溶液中含有过量的硫酸,所以溶质中还含有硫酸;加入铁粉是利用铁与硫酸铜反应生成铜和硫酸亚铁,将铜置换出来,得到硫酸亚铁,铁与硫酸反应生成硫酸亚铁和氢气,也是获得硫酸亚铁,所以加入略过量的铁粉,过量的目的是使CuSO4、H2SO4完全反应;固体C中可能含有铁所以先用硫酸清洗把铁除掉,再用水冲洗,最后进行干燥就能得到铜了;
根据质量守恒定律分析铜生锈条件,根据对比实验法探究铜生锈的条件分析应进行的实验.
解答 解:由题意可知,废料中的铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水,所以蓝色溶液中的溶质中含有硫酸铜,根据蓝色溶液中加入铁有气体产生,说明蓝色溶液中含有过量的硫酸,所以溶质中还含有硫酸;加入铁粉是利用铁与硫酸铜反应生成铜和硫酸亚铁,将铜置换出来,得到硫酸亚铁,铁与硫酸反应生成硫酸亚铁和氢气,也是获得硫酸亚铁,所以加入略过量的铁粉,过量的目的是使CuSO4、H2SO4完全反应;固体C中可能含有铁所以先用硫酸清洗把铁除掉,再用水冲洗,最后进行干燥就能得到铜了.所以:(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是过滤.
(2)由上述分析可知,蓝色溶液B中的溶质是 CuSO4、H2SO4.
(3)由上述分析可知,步骤Ⅲ中发生反应的化学方程式是:Fe+H2SO4═FeSO4+H2↑.
(4)硫酸亚铁可用作治疗贫血症的药物.
5)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3].根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜锈需要空气中的H2O、CO2.若要探究“铜生锈是否需要空气中的氧气?”如图2所示实验中,只需完成BD两个实验即可达到实验目的.
故答为:(1)过滤.(2)CuSO4、H2SO4.(3)Fe+H2SO4═FeSO4+H2↑.(4)贫血症.(5)铜H2O、CO2,BD.
点评 解答本题关键是要知道置换铜必须用铁,因为还要得到硫酸亚铁,为了反应充足加入的试剂要过量,再利用铁能与硫酸反应,铜不能与硫酸反应将铜和铁分开.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 科学家发现,海底可燃冰分布的范围约占海洋总面积的10%,其储量是煤、石油和天然气总和的两倍,是迄今为止发现的海底最具价值的矿产资源.可燃冰也称为“甲烷水合物”.“置换法”是开采可燃冰设想方案之一,即将CO2注入海底的甲烷水合物储层,CO2较甲烷更易形成水合物,因而就能将甲烷水合物中的甲烷分子“挤走”,从而将其“置换”出来(原理:CH4•nH2O+CO2═CO2•nH2O+CH4).
科学家发现,海底可燃冰分布的范围约占海洋总面积的10%,其储量是煤、石油和天然气总和的两倍,是迄今为止发现的海底最具价值的矿产资源.可燃冰也称为“甲烷水合物”.“置换法”是开采可燃冰设想方案之一,即将CO2注入海底的甲烷水合物储层,CO2较甲烷更易形成水合物,因而就能将甲烷水合物中的甲烷分子“挤走”,从而将其“置换”出来(原理:CH4•nH2O+CO2═CO2•nH2O+CH4).查看答案和解析>>
科目:初中化学 来源: 题型:推断题
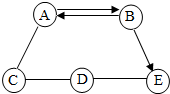 A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).请回答下列问题:
A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | R>Cu | B. | R>Fe | C. | Zn>R | D. | R>Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | a1 | a2 | a3 | b1 | b2 | b3 | c1 | c2 | c3 |
| 溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
| 水的温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 70 |
| 溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶液pH | 11.22 | 11.35 | 11.46 | 11.48 | 11.50 | 11.50 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | N2 | B. | NO | C. | N2O | D. | NO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com