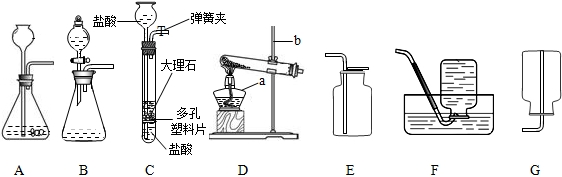
解:(1)识别仪器,故答案为:酒精灯、铁架台.
(2)粉末碳酸钙和盐酸接触面积大,反应较快,气体不好收集,所以用大理石固体.故答案为:化学反应速度太快来不及收集气体(或反应速率太快不易控制反应进行,不便于实验操作)等,CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O.
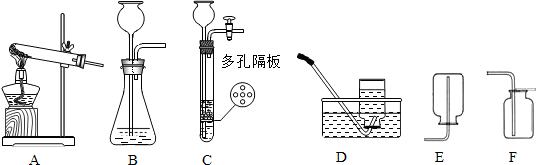
(3)比较发现C多一个弹簧夹和隔板,一旦关闭弹簧夹,随着气体的增多,会是液体和固体分离,反应停止.故答案为:能使反应随开随用,随关随停(或随时使反应发生,随时使反应停止).
(4)实验室用加热无水乙酸钠固体和氢氧化钠固体制取甲烷气体,发生装置属于固体和固体加热制气体;甲烷不溶于水,可以采用排水法收集,故答案为:D F.
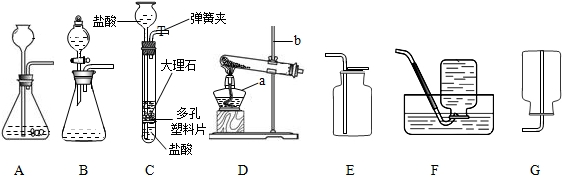
(5)根据质量守恒定律可知,反应后固体物质的质量减小了,但是二氧化锰的质量不变(催化剂),所以二氧化锰的质量分数增大.故答案为:2KClO
3
2KCl+3O
2↑,变大.
(6)①稀释前后溶质的质量不变,设需要30%双氧水溶液的质量为X,则X×30%═510×5%,得:X=85
②双氧水的物质的量:
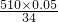
═0.75(摩尔)
③设:可制得氧气为X摩尔.
2H
2O
2 
2H
2O+O
2↑
2 1
0.75 x
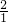
═
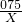
x=0.375(摩尔)
答:可制得氧气为0.375摩尔.
分析:(1)识别仪器.
(2)粉末碳酸钙和盐酸接触面积大,反应较快,气体不好收集,因此用大理石固体.
(3)比较发现C多一个弹簧夹和隔板,一旦关闭弹簧夹,随着气体的增多,会是液体和固体分离,反应停止.
(4)根据发生装置和收集装置的选择条件即可.
(5)根据质量守恒定律可知,反应后固体物质的质量减小了,所以二氧化锰的质量分数增大.
(6)根据化学方程式计算即可,注意规范.
点评:掌握发生装置和收集装置的选择条件,同时记住随时开始,随时停止的仪器特点,还有催化剂的质量前后不变.

 2KCl+3O2↑,变大.
2KCl+3O2↑,变大.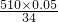 ═0.75(摩尔)
═0.75(摩尔) 2H2O+O2↑
2H2O+O2↑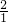 ═
═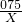


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案